Una mujer de 58 años fue atendida en consultorio externo de neurología ambulatoria a principios de otoño por hipoestesia, parestesia y debilidad.
La paciente había estado bien hasta 10 semanas antes de esta presentación, cuando comenzó con dolor entre ambos omóplatos. El dolor se resolvió durante las siguientes 2 semanas en forma espontánea. Seis semanas antes de la consulta actual, comenzó con entumecimiento en una distribución similar a una banda alrededor de su tronco, que iba desde el área entre los omóplatos y el área debajo de las mamas.
Cinco semanas antes de la consulta actual, el adormecimiento se extendió hasta la parte superior del abdomen. La paciente no podía sentarse desde la posición supina sin utilizar los brazos, y comenzó a presentar distensión abdominal. Cuatro semanas antes de la consulta actual, desarrolló parestesias en los dedos tercero, cuarto y quinto de la mano izquierda y los dedos cuarto y quinto de la mano derecha. La paciente fue atendida en una clínica donde se programó una resonancia magnética (IRM) de la columna vertebral. Sin embargo, 2 semanas antes de la consulta actual, el entumecimiento se extendió al área de los genitales comenzando a presentar incontinencia urinaria, lo que llevó a la consulta urgente al hospital.
En el servicio de urgencias, la paciente refirió no tener fiebres, sudores nocturnos, cambio en el peso, debilidad en el brazo, debilidad en las piernas o cambio en la marcha. Ella tenía una historia de hipertensión, hipotiroidismo y estenosis espinal sintomática, por lo que se había sometido a descompresión L4-L5 y fascectomía medial bilateral 6 años antes. Ella también se había sometido a reducción abierta y a fijación por fracturas en tibia y peroné izquierdos resultantes de una caída, así como escisión de un cuerpo extraño que había pinchado su eminencia tenar derecha.
Tres meses antes de la consulta actual, la paciente había notado un área eritematosa no dolorosa ni pruriginosa que medía 8 cm de diámetro en el pliegue glúteo izquierdo que pensó que se trataba de una picadura de insecto. No presentó fiebre, y el eritema se resolvió en 4 semanas. La única medicación del paciente era levotiroxina, y ella era alérgica a la penicilina. Ella bebía alcohol raramente, había fumado tabaco en el pasado, y no consumía drogas ilícitas. Estaba casada y vivía con su marido en un área boscosa en el noreste de Connecticut. Ella trabajaba en el cuidado de la salud. No había historia familiar de enfermedad neurológica.
En el examen, la temperatura era de 36,6 ° C, la presión arterial de 144/75 mm Hg, la frecuencia cardíaca. 84 latidos por minuto, y la frecuencia respiratoria 18 por minuto. El peso era de 74,8 kg, y el índice de masa corporal de 25.8. Había disminución de la sensibilidad en la parte posterior y anterior del tronco y el abdomen. El abdomen estaba distendido El resto del examen era normal La glucemia fue de 291 mg por dl. El nivel de electrolitos en sangre eran normales, al igual que los resultados de las pruebas de función renal y hepática, un recuento sanguíneo completo, y el recuento diferencial. Se realizaron estudios de imágenes.
La resonancia magnética de columna cervical torácica y lumbar sin contraste, la que no reveló compresión de la médula espinal, ni alteraciones de la señal medular, ni colección epidural. Había cambios degenerativos a varios niveles de la columna vertebral, así como cambios postquirúrgicos relacionados con la descompresión remota L4 – L5 sin estenosis del canal espinal de alto grado o pinzamientos de raíces nerviosas Las raíces nerviosas del cono medular y de cauda equina parecían ser normales, y no había evidencia de engrosamiento o agrupación de las raíces nerviosas.
Dos semanas más tarde, fue vista en neurología ambulatoria del hospital donde refirió que las parestesias en las manos eran estables, y presentaba entumecimiento continuo de tronco y abdomen, refería nuevo adormecimiento de la parte superior y anterior de piernas y hacía 5 días que no podía levantar hacia arriba mientras caminaba. También refirió dificultades para tomar respirar profundo y toser.
En el examen, la temperatura era de 36,4 ° C, la presión arterial 106/67 mm Hg, la frecuencia cardíaca. 77 latidos por minuto, y la frecuencia respiratoria 16 respiraciones por minuto. El estado mental del paciente era normal, al igual que los resultados de las pruebas de los nervios craneales desde el 2 al 12. La fuerza era 4/5 durante la flexión de la muñeca izquierda, 5/5 mientras que el paciente estaba agarrando los dedos del examinador, 4/5 durante la dorsiflexión del pie izquierdo, y 4/5 durante extensión de los dedos del pie izquierdo. Cuando la paciente intentó caminar con sus talones, ella fue incapaz de mantener su antepié izquierdo sin tocar el suelo. La excursión diafragmática, medida por percusión a lo largo de la región posterior del tórax era simétrica. Había disminución del tono en los músculos rectos abdominales con distensión abdominal asociada. La paciente no podía levantarse de la posición supina sin asistencia del examinador. Había sensibilidad disminuida superficial y al pinchazo en una distribución en forma de banda alrededor del dermatoma D6 hasta el dermatoma D12.
Los reflejos tendinosos profundo estaban ausentes en el bíceps en el lado izquierdo y en los tobillos bilateralmente.
El resto del examen neurológico y médico era normal
Las pruebas de laboratorio revelaron un nivel de hemoglobina glucosilada era de 11.8% (rango de referencia, menos de 5.7). Tasa de sedimentación de eritrocitos de 25 mm por hora (rango de referencia, menos de 30), y niveles normales de tirotropina, creatina quinasa, vitamina D, vitamina B12, y el folato.
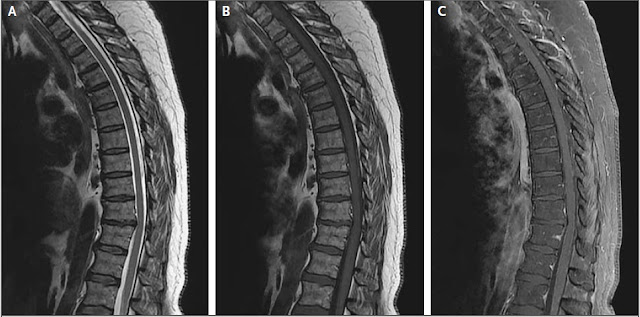
Radiografías de tórax obtenidas en inspiración y espiración no mostraron evidencia de opacidad parenquimatosa, derrame pleural, o linfadenopatía. Movimientos hemidiafragmáticos entre la inspiración y la expiración estaban presentes bilateralmente. En la resonancia magnética de la torácica y columna lumbar sin realce de contraste, los hallazgos fueron estables, en comparación con los estudios anteriores. En la resonancia magnética de la columna torácica con contraste, no hubo evidencia de señal medular anormal o realce meníngeo (fig. 1).
Figura 1. RMN de columna torácica.
La RMN de la espina torácica llevada a cabo 1 semana después de que la paciente fuese evaluada en emergencias.
Sagital: imágenes de la espina obtenidas a través de la línea media. Una secuencia T2 (Panel A), una secuencia T1 sin contraste (Panel B), y una secuencia con saturación grasa (Panel C) no muestran evidencias de anormalidades de la señal medular ni alto grado de estenosis ni realces anormales.
Se realizó una prueba diagnóstica.
DIAGNÓSTICO DIFERENCIAL
El primer paso en la evaluación de ésta paciente con un potencial problema neurológico es definir el síndrome, es decir, localizar neuroanatómicamente el problema en el contexto del perfil temporal presentado. Durante un período de 10 semanas, ésta paciente tuvo dolor de espalda seguido de debilidad en músculos de las paredes abdominales y torácicas, sensibilidad troncal reducida con afectación de los genitales, debilidad multifocal arrefléxica en brazos y piernas, y probable incontinencia urinaria con rebosamiento urinario. La localización del proceso nos permitirá desarrollar un diferencial inicial y reducir así el espectro de posibilidades diagnósticas.
LOCALIZACIÓN
El síntoma inicial de este paciente fue dolor entre los omóplatos. El dolor es el síntoma menos específico, pero localiza la lesión en algún lugar del sistema nervioso periférico, con pocas excepciones. La lesión de las raíces nerviosas espinales sensitivas comúnmente causa dolor de espalda que irradia a la axila o fosas lumbares.
Un componente clave de la evaluación neuromuscular de ésta paciente fue el examen de los músculos de la pared abdominal, que permiten la flexión del tronco, la exhalación completa y evita la protrusión del contenido abdominal. No se menciona en la historia, si la paciente tenía el signo de Beevor (desviación del ombligo alejándose del segmento débil del músculo recto abdominal en la contracción de los músculos de la pared abdominal). Sin embargo, sabemos que la paciente no podía sentarse desde la posición supina, y tenía distensión abdominal que estaba relacionada con la disminución del tono muscular de la pared abdominal. La presencia simultánea de entumecimiento o alteraciones sensitivas descarta una miopatía, por lo que sospechamos que la debilidad de los músculos de la pared abdominal se localiza en las raíces nerviosas dorsales inferiores o lumbares superiores.
La paciente refería dificultad para tomar una respiración profunda y toser, lo que podría ser un signo de debilidad diafragmática por disfunción de la médula cervical superior o tronco encefálico. Sin embargo, ella no tenía debilidad en la flexión del cuello ni disfagia orofaríngea, y la excursión diafragmática en el examen físico por percusión era normal. Otra causa potencial de la dificultad de este paciente para tomar una respiración profunda es la debilidad de los músculos intercostales externos, que ayudan en la expansión de la cavidad torácica durante la inspiración y están inervados por raíces nerviosas dorsales segmentarias.
Consideremos ahora los síntomas sensitivos de la paciente. La reducción de la sensibilidad del tronco implica disfunción de los tractos sensoriales medulares, raíces nerviosas sensitivas, ganglios de la raíz dorsal o nervios segmentarios en los niveles afectados. La pérdida sensorial de ésta paciente tiene una distribución en forma de una banda o suspendida, lo que significa que tenía límites superiores e superior inferiores. La presencia de un nivel sensitivo suspendido podría ser consistente con una pequeña lesión central de la médula o quiste (siringo), con interrupción de la decusación o entrecruzamiento de las fibras del tracto espinotalámico en la comisura ventral. Las lesiones medulares centrales pueden causar dolor, y si son lo suficientemente grandes, pueden afectar las astas anteriores, resultando en debilidad segmentaria arrefléxica. Sin embargo, varias características de la presentación de ésta paciente argumentan en contra de una lesión medular central. Las lesiones medulares centrales dan como resultado déficits contiguos, mientras que ésta paciente tenía entumecimiento no contiguo que involucraba los segmentos cervicales inferiores, dorsales inferiores y segmentos sacros, sin compromiso de los segmentos cervicales superiores y lumbares inferiores. Además, el adormecimiento del área genital argumenta en contra de una lesión medular central, debido a que las fibras del tracto espinotalámico que se originan en el segmento sacro se ubican lateralmente dentro del tracto y suelen respetarse. La paciente también tenía incontinencia urinaria, un síntoma que no se esperaría que ocurriera con pequeñas lesiones medulares centrales o siringomielia. Finalmente, la paciente no tenía signos mielopáticos, como la paraparesia espástica, hiperreflexia, o signos sensitivos cruzados lo que sugeriría una una gran lesión medular.
Un nivel sensitivo suspendido también puede resultar de la disfunción de la raíz del nervio sensitivo espinal o del ganglio. Una ganglionopatía sensitiva puede descartarse porque la paciente también tenía debilidad. En general, su síndrome es más consistente con una polirradiculopatía o polirradiculoneuropatía, con afectación inicial del segmento torácico medio e inferior, seguido por la participación cervical baja, dorsal superior, lumbar y sacro.
DIAGNÓSTICO DIFERENCIAL DE POLIRRADICULOPATÍAS
POLIRRADICULOPATÍA DIABÉTICA
Hay varios desórdenes que causan o imitan polirradiculopatía subaguda o polirradiculoneuropatía con hallazgos potencialmente normales en las imágenes de la columna vertebral, como se describe en ésta paciente. Entre los más comunes de estos trastornos se encuentra la polirradiculopatía torácica diabética, que es el equivalente fisiopatológico de la neuropatía o radiculopatía diabética cervical o lumbosacra. Una cuarta parte de los casos de polirradiculopatía torácica aguda o subaguda coincide con un diagnóstico reciente de diabetes mellitus lo que encaja con ésta paciente con niveles elevados de glucosa en sangre y niveles altos de hemoglobina glicosilada recientemente descubiertos. Sin embargo, los pacientes con polirradiculopatía diabética suele tener un pródromo de síntomas constitucionales que incluyen pérdida de peso y malestar, así como síntomas de fallo autonómico, y tales síntomas no fueron vistos en ésta paciente. Además, los síntomas de la radiculopatía diabética son a menudo bilaterales pero usualmente asimétricos y limitados a un segmento (cervical, torácica o lumbosacro) .2 Creemos que la polirradiculopatía torácica diabética es improbable en este caso.
MONONEUROPATÍAS MÚLTIPLES
Aunque el síndrome de mononeuropatías múltiples (mononeuritis múltiple) no es una polirradiculopatía, debe ser considerada en ésta paciente con dolor, pérdida sensorial multifocal, dada la importancia del reconocimiento temprano de una vasculitis sistémica subyacente, o vasculitis del sistema nervioso periférico.3 Sin embargo, en pacientes con mononeuropatías múltiples, los síntomas se desarrollan en una distribución al azar del nervio periférico, y en ésta paciente los síntomas fueron más radiculares. Además, ésta paciente tenía síntomas predominantemente troncales, lo que sería inusual en múltiples mononeuropatías, porque a menudo afecta el trayecto largo de nervios en los brazos y piernas, dada su relativa alta susceptibilidad a la isquemia asociada a la vasculitis asociada.
POLINEUROPATÍAS INFLAMATORIAS
Otra consideración importante en ésta paciente es una neuropatía motora y sensitiva desmielinizante adquirida multifocal (multifocal acquired demyelinating sensory and
motor neuropathy (MADSAM), una variante de la polineuropatía inflamatoria desmielinizante crónica (CIDP)4, que causa dolor, pérdida sensorial multifocal, y debilidad de la flexión en una distribución nerviosa radicular o periférica. La MADSAM más comúnmente involucra nervios largos, aunque los nervios craneales también pueden verse afectados. Sin embargo, la presentación predominantemente troncal en ésta paciente sería inusual con este diagnóstico.
CÁNCER
La carcinomatosis leptomeníngea o la linfomatosis son una consideración diagnóstica en ésta paciente. Las raíces nerviosas espinales y craneales pueden dañarse a medida que pasan por las meninges enfermas. Sin embargo, éste síndrome rara vez es parte de la presentación inicial de cáncer, y este paciente no tenía otros signos o síntomas sugestivos de cáncer avanzado. Además, ella no tenía hallazgos sugestivos de enfermedad leptomeníngea en la resonancia magnética. Aunque el análisis del líquido cefalorraquídeo (LCR) o biopsia meníngea serían necesarios para descartar este diagnóstico, sospechamos que otras posibles causas de su enfermedad son más probables.
NEUROSARCOIDOSIS
La neurosarcoidosis tiene manifestaciones proteiformes, que puede incluir polirradiculopatía torácica. La sarcoidosis tiene una predilección por la participación de las raíces nerviosas sensitivas y ganglios pero más comúnmente afecta las raíces de los nervios craneales y los nervios ópticos. Los pacientes con neurosarcoidosis a menudo tienen enfermedad sistémica y hallazgos anormales en las neuroimágenes, características que no se vieron en ésta paciente. Aunque la neurosarcoidosis no se puede descartar, consideraremos otras posibles causas de presentación en ésta paciente.
INFECCIÓN
¿Podría este paciente tener herpes zoster? La reactivación del virus varicela-zoster latente surge en la ganglios de la raíz dorsal y se propaga centrífugamente a la piel a lo largo de los nervios sensitivos o vasa nervorum. Los pacientes con herpes zoster suelen tener dolor dermatomal severo y déficits sensoriales; una erupción segmentaria es común pero no siempre presente. En algunos casos, los pacientes con herpes zóster tienen debilidad segmentaria de los brazos, piernas o músculos torácicos. Sin embargo, aunque los pacientes con herpes zoster sensitivo pueden tener síntomas sin erupción herpética, esto casi nunca es el caso en pacientes con paresia segmentaria por zóster. Adicionalmente, la enfermedad casi siempre se limita a uno o muy pocos segmentos.5
Los pacientes con meningoradiculitis de Lyme típicamente se presentan de 2 a 18 semanas después de la infección, durante la fase temprana de diseminación, con dolor, pérdida sensorial, y debilidad arrefléxica. Más de la mitad de pacientes con meningorradiculitis de Lyme se presentan con parálisis del séptimo nervio craneal (una manifestación de la enfermedad de Lyme que muchos reconocen), pero cualquier raíz nerviosa craneal o espinal pueden ser involucradas. Varias pistas en la historia de ésta paciente apuntan hacia éste diagnóstico. Primero, ella vive en una zona boscosa en una región del país donde la enfermedad de Lyme es endémica. Segundo, ella se presentó a principios de otoño, y aproximadamente 3 meses antes, ella había tenido una pequeña, erupción uniformemente eritematosa, indolora y no pruríginosa que fue compatible con el marcador inicial de la enfermedad de Lyme, el eritema migrans. Aunque la erupción clásica de la enfermedad de Lyme se describe como con un centro claro (en ojo de buey), en muchos casos, ésta característica no se ve. En tercer lugar, la ubicación de la erupción de la paciente en el pliegue glúteo izquierdo es un sitio común de picaduras de garrapatas; otros lugares incluyen las axilas, la línea del cabello, la ingle y la línea del cinturón.6 Dado el momento estacional de la presentación de ésta paciente, la historia de una erupción consistente con eritema. migrans, y su síndrome clínico de polirradiculopatía, sospechamos que ésta paciente tuvo meningoradiculitis de Lyme en el contexto de la diseminación temprana de la enfermedad de Lyme. El siguiente paso diagnóstico sería el análisis del suero y del LCR para anticuerpos contra Borrelia burgdorferi.
DIAGNOSTICO CLÍNICO DE SOSPECHA
MENINGORADICULITIS DE LYME EN EL CONTEXTO DE ENFERMEDAD DE LYME DISEMINADA TEMPRANA.
DISCUSION PATOLOGICA
Las pruebas de laboratorio que fueron realizadas para apoyar el diagnóstico fueron pruebas de anticuerpos para la borreliosis de Lyme en suero. Un primer nivel ensayo inmunoenzimático (ELISA) fue reactivo. Ensayos de inmunotransferencia de IgM e IgG. El suero para ensayo de inmunotransferencia de IgM mostró 1 de 3 bandas específicas (la banda de 39 kDa), que es un resultado negativo según los Centros para el Control de Enfermedades y criterios de prevención (CDC) .7 El suero para ensayo de inmunotransferencia de IgG mostró 9 de 10 bandas específica, que es un resultado positivo según los criterios de los CDC.7 Las pruebas indicaron una respuesta expansiva de anticuerpos de B. burgdorferi con un switch de inmunoglobulina de IgM a IgG; estos resultados corresponden a una infección por B. burgdorferi de al menos 1 o 2 meses de duración, y se correlacionan bien con la historia clínica de la paciente. Además de las pruebas de anticuerpos séricos, ensayos para IgM e IgG para B. burgdorferi en LCR por PCR para B. mayonii, B. garinii y B. afzelii fueron realizados
Cuando un paciente es seropositivo y tiene un característico síndrome clínico de neuroborreliosis de Lyme, como en este caso, las pruebas del LCR para la enfermedad de Lyme son innecesarios para establecer un diagnóstico.
Cuando se sospecha neuroborreliosis de Lyme con compromiso de nervioso central, la detección de anticuerpos intratecales de B. burgdorferi puede servir para apoyar el diagnóstico, pero su ausencia no descarta el diagnóstico. El mejor método para la detección de anticuerpos intratecales de B. burgdorferi es la determinación del índice suero/LCR de anticuerpos con ELISA cuantitativo o similares, en lugar de ensayos de inmunotransferencia. Sustanciales diferencias entre los resultados en suero y los ensayos de inmunotransferencia de LCR no son confiables cuando hay producción intratecal de anticuerpos de B. burgdorferi.8 En el LCR de ésta paciente el ensayo de inmunotransferencia de IgG mostró 5 bandas específicas y el ensayo de inmunotransferencia IgM de LCR no mostró bandas.
El diagnóstico fue entonces de meningoradiculitis de Lyme.
DISCUSIÓN DEL MANEJO
No es infrecuente durante los meses de verano y otoño en Nueva Inglaterra hacer un diagnóstico de polirradiculitis meningoradiculitis de Lyme en un paciente que se presenta con un síndrome de radiculitis subaguda, multifocal, dolorosa. El síndrome suele afectar a los brazos y las piernas de una manera asimétrica y está a menudo asociado a parálisis de nervios craneales. La diferencia de ésta paciente , es que los síntomas involucraron principalmente el tronco, mientras que la participación de los brazos y piernas fue menos prominente. Tal presentación puede conducir a varios retos diagnósticos. Las causas del dolor visceral a menudo se investigan adecuadamente y las causas neurológicas no son consideradas a menos que el paciente también tenga parestesias, que sirven como una pista de una causa neurológica de dolor. Además, el examen sensorial y de la fuerza del tronco y del abdomen a menudo son pasadas por alto y no se realizan. En ésta paciente, el examen la sensibilidad en la piel del abdomen y paredes torácicas y el examen de los músculo de la pared abdominal fueron fundamentales para llegar a un correcto diagnostico La enfermedad de Lyme tiene predilección por afectación de las raíces nerviosas torácicas en algunos pacientes. La base para esto no se conoce, pero hay una sugerencia de que la localización podría estar relacionada con el sitio de inoculación de la infección.
Tras la confirmación del diagnóstico, la paciente recibió un curso de 3 semanas de ceftriaxona intravenosa.
Su diabetes fue tratada con una escala de insulina inicialmente, seguida de metformina.
La ausencia de neuropatía sensitiva simétrica distal y el rápido desarrollo de polirradiculopatía asimétrica acompañada de pleocitosis del LCR hizo que el diagnóstico de polirradiculopatía diabética quedara relegado. El dolor disminuyó en el curso de un período de 4 semanas. Cuando la paciente fue vista 4 meses después del inicio del tratamiento con ceftriaxona, su sensibilidad y la fuerza de la pared abdominal habían aumentado de tal manera que podía contraer el músculo recto abdominal, pero ella continuó teniendo dificultad para sentarse desde la posición supina. La debilidad del pie izquierdo había disminuido, pero ella aun tenia dificultad para caminar sobre sus talones
DIAGNOSTICO FINAL
MENINGORRADICULITIS DE LYME.
Traducción de
Case 34-2018: A 58-Year-Old Woman with Paresthesia and Weakness of the Left Foot and Abdominal Wall
Haatem M. Reda, M.D., H. Benjamin Harvey, M.D., J.D., Nagagopal Venna, M.D., and John A. Branda, M.D.
Referencias
1. Wijdicks EFM. The neurology of acutely failing respiratory mechanics. Ann Neurol 2017; 81: 485-94.
2. Sinnreich M, Taylor BV, Dyck PJ. Diabetic neuropathies: classification, clinical
features, and pathophysiological basis. Neurologist 2005; 11: 63-79.
3. Gwathmey KG, Burns TM, Collins MP, Dyck PJ. Vasculitic neuropathies. Lancet Neurol 2014; 13: 67-82.
4. Saperstein DS, Katz JS, Amato AA, Barohn RJ. Clinical spectrum of chronic acquired demyelinating polyneuropathies. Muscle Nerve 2001; 24: 311-24.
5. Jones LK Jr, Reda H, Watson JC. Clinical, electrophysiologic, and imaging features of zoster-associated limb paresis. Muscle Nerve 2014; 50: 177-85.
6. Smith RP, Schoen RT, Rahn DW, et al. Clinical characteristics and treatment outcome of early Lyme disease in patients with microbiologically confirmed erythema migrans. Ann Intern Med 2002; 136: 421-8.
7. Recommendations for test performance and interpretation from the Second National Conference on Serologic Diagnosis of Lyme Disease. MMWR Morb Mortal Wkly Rep 1995; 44: 590-1.
8. Wilske B, Schierz G, Preac-Mursic V, et al. Intrathecal production of specific antibodies against Borrelia burgdorferi in patients with lymphocytic meningoradiculitis
(Bannwarth’s syndrome). J Infect Dis 1986; 153: 304-14.
9. Avery RA, Frank G, Eppes SC. Diagnostic utility of Borrelia burgdorferi cerebrospinal
fluid polymerase chain reaction in children with Lyme meningitis. Pediatr
Infect Dis J 2005; 24: 705-8.
10. Dumler JS. Molecular diagnosis of Lyme disease: review and meta-analysis.Mol Diagn 2001; 6: 1-11.