Una mujer de 19 años ingresó en la unidad de cuidados intensivos pediátricos de este hospital en otoño debido a dolor de cabeza, fiebre, fotofobia, rigidez del cuello y cambios en el estado mental.
La paciente había estado bien hasta 7 días antes del ingreso, cuando se desarrollaron dolor de cabeza y náuseas. Fue vista en el departamento de emergencias de un hospital en Massachusetts 6 días antes del ingreso. El examen físico y los resultados de las pruebas de laboratorio fueron normales. Se administraron líquidos intravenosos y ketorolac, con mejoría. Se hizo un diagnóstico de cefalea tensional o migraña, y regresó a su residencia universitaria.
Dos días después, la paciente vomitó y se desmayó después de pararse. Regresó al hospital esa noche; El examen reveló una temperatura de 38,4 ° C y por lo demás era normal. El hematocrito, el nivel de hemoglobina, el recuento de plaquetas y los resultados de las pruebas de función renal y hepática fueron normales. Las pruebas de mononucleosis, faringitis estreptocócica e influenza resultaron negativas y el análisis de orina reveló sangre pero la paciente estaba menstruando por lo que se interpretó que esa era la causa. Se administraron líquidos intravenosos, ketorolac, metoclopramida y ondansetrón, con cierta mejoría. Se hizo un diagnóstico de posible dolor de cabeza por migraña y la paciente regresó nuevamente a su residencia universitaria. Al día siguiente, la fiebre persistió y los padres de la paciente, que habían viajado desde su casa para estar con ella, le administraron amoxicilina (obtenida de familiares que eran médicos) e ibuprofeno. El día anterior al ingreso, se produjo otro episodio de síncope, sin traumatismo craneal, después de que el paciente se levantara de la cama. Ella fue al departamento de emergencias de otro hospital.
La paciente reportó un dolor de cabeza parietal bilateral caracterizado como “el peor de su vida”, fiebre, fotofobia, escalofríos, sudores nocturnos, náuseas, vómitos, mareos con cambios de posición, rigidez en el cuello que duró 2 días, dolor de garganta leve, sin tos ni dolor abdominal. En el examen, se informó que la temperatura era inferior a 37.1 ° C, la presión arterial de 97/64 mm Hg, el pulso de 99 latidos por minuto, la frecuencia respiratoria 20 respiraciones por minuto y la saturación de oxígeno del 96% mientras ella respiraba aire ambiente; El resto del examen era normal. El hematocrito, el nivel de hemoglobina y los resultados de las pruebas de función renal y hepática fueron normales. La prueba de reacción de polimerasa en cadena (PCR) para ácido nucleico de Babesia microti fue negativa, al igual que las pruebas para Anaplasma phagocytophilum, especies de ehrlichia y anticuerpos contra la enfermedad de Lyme. Otros resultados de la prueba se muestran en la Tabla 1
TABLA 1
Datos de laboratorio.
Se realizó punción lumbar; los resultados del análisis del líquido cefalorraquídeo (LCR) se muestran en la Tabla 1. El análisis de orina reveló una cantidad moderada de sangre, con 5 glóbulos rojos por campo de alta potencia (2 días después de la menstruación); Una prueba de embarazo en orina fue negativa. La prueba de muestras de garganta para estreptococos del grupo A y de muestras nasales para virus de influenza A y B fue negativa. Una tomografía computarizada (TC) de la cabeza, obtenida sin la administración de material de contraste, fue normal, al igual que una radiografía de tórax.
El paciente recibió 3 litros de solución salina normal (administrada por vía intravenosa durante un período de 3 horas), difenhidramina, metoclopramida y ketorolaco. Fue ingresada en la unidad de observación del segundo hospital. Durante la noche, la temperatura subió a 39.0 ° C, y se produjo una visión doble intermitente y una dificultad creciente para la ambulación y la micción. Por la mañana, parecía adormecida y estaba desorientada con respecto al año. Tenía rigidez en el cuello, ataxia troncal, nistagmo rotatorio, entumecimiento de la cara y el brazo derecho, y una incapacidad para realizar el recuerdo inmediato de tres palabras. La fuerza y la sensación eran normales. La uretra se cateterizó y se drenó 1 litro de orina; Se colocó un catéter permanente. Un electrocardiograma mostró ritmo sinusal a una frecuencia de 57 latidos por minuto, un intervalo PR de 92 ms, y anomalías no específicas de la onda T. Las mediciones de los gases de la sangre venosa se muestran en la Tabla 1.
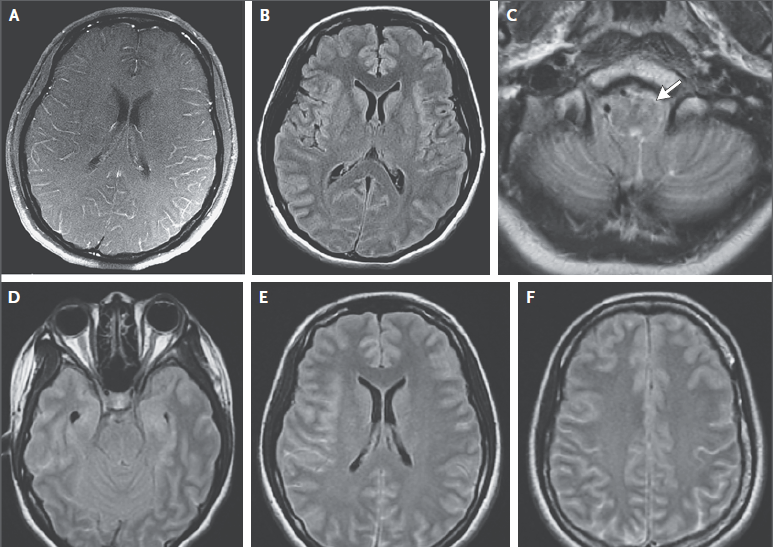
La resonancia magnética (RM) de la cabeza se realizó después de la administración de gadolinio y reveló un realce leptomeníngeo difuso (Figura 1A).
Figura 1
Imágenes de RMN de cráneo.
Las imágenes de resonancia magnética de la cabeza, obtenidas en el otro hospital después de la administración de gadolinio, muestran un realce leptomeníngeo difuso (Panel A). Una imagen de FLAIR muestra hiperintensidad sulcal difusa (Panel B), y una imagen ponderada en T2 muestra una alteración de la señal hiperintensa mal definida y expansión del bulbo raquídeo (Panel C, flecha). En la admisión del paciente a este hospital, se obtuvieron imágenes de resonancia magnética de la cabeza sin la administración de gadolinio (paneles D, E y F). Las imágenes de FLAIR muestran una hiperintensidad sulcal difusa que se ha incrementado desde el examen de RMN anterior. Existe una anomalía en la señal difusa en el cerebelo y el borramiento de la folia del cerebelo, hallazgos compatibles con edema cerebeloso difuso. El borramiento de los surcos se ha incrementado desde el examen previo de RMN, y está presente el borramiento de las cisternas basales; Estos hallazgos son consistentes con edema cerebral.
Las imágenes de FLAIR mostraron hiperintensidad sulcal difusa (Figura 1B); Las imágenes ponderadas en T2 mostraron una anomalía de señal sutil y mal definida y una expansión leve de la médula (Figura 1C). Hubo un leve borrado de los surcos que sugería un edema cerebral, pero las cisternas basales estaban intactas.
Se administraron aciclovir (10 mg por kilogramo de peso corporal cada 8 horas), ampicilina (2 g cada 4 horas), meclizina, ondansetrón, acetaminofeno e ibuprofeno. La paciente fue trasladada a este hospital e ingresada en la unidad de cuidados intensivos pediátricos.
La paciente tenía antecedentes de dolor de cabeza, eccema y ampollas orales cuando tenía fiebre. Dos semanas antes del ingreso, según se refirió, había tenido una enfermedad diarreica. Antes de esta enfermedad, ella había tomado biotina para el acné; sus inmunizaciones eran correctas. Ella no tenía alergias conocidas. Era de ascendencia del este de Asia, se crió en el sur de los Estados Unidos y vivía en una residencia universitaria en Massachusetts. No fumaba, no tomaba alcohol ni consumía drogas ilícitas. No era sexualmente activa, no había viajado recientemente y no había informado sobre exposiciones a personas enfermas, animales de granja o domésticos, carnes crudas o productos lácteos sin pasteurizar, ni picaduras de mosquitos o garrapatas. No había antecedentes familiares de esclerosis múltiple, hemorragia subaracnoidea, enfermedad autoinmune o enfermedad del tejido conectivo.
En el examen, la paciente estaba despierta, alerta y orientada con respecto a su nombre y su padre, pero no el lugar ni el momento; ella respondió "sí" o "no" a las preguntas, pero a menudo gritaba en chino o con palabras ininteligibles. Los signos vitales eran normales. Había rigidez nucal. Sus ojos estaban abiertos la mayor parte del tiempo, con movimientos oculares ascendentes lentos constantes y una desviación predominantemente hacia arriba. La pupila derecha era normal; La pupila izquierda fue difícil de evaluar debido a los movimientos oculares. Cerraba los ojos con fuerza igual en ambos y se resistía a abrirlos. Un examen de la sensibilidad, que fue de valor limitado debido a su capacidad de atención fluctuante y el dolor de la rigidez de la nuca, reveló una sensibilidad disminuida en el lado izquierdo de la cara, disminución de la sensación al tacto ligero en el brazo derecho, sensación intacta al tacto ligero en el brazo izquierdo, y la retirada de un estímulo nocivo leve a las piernas. Su fuerza era 4− / 5 en la extensión del hombro (antigravedad con poca resistencia) y 2/5 en la flexión de la cadera (una incapacidad para superar la gravedad), con una mayor disminución del tono en la pierna izquierda que en la pierna derecha. Los reflejos eran enérgicos en todo momento, con dos o tres movimientos de clonus en el tobillo derecho. El reflejo plantar derecho era flexor y el reflejo plantar izquierdo estaba ausente. Las pruebas cerebelosas no se realizaron debido al estado neurológico general del paciente. Se observaron inyección conjuntival palpebral moderada y linfadenopatía cervical no hipersensible, y el resto del examen fue normal.
Durante los primeros 30 minutos después de su llegada, la condición de la paciente empeoró; era incapaz de seguir las órdenes y cada vez tenía mayor dificultad y hablaba sin sentido. La sedaron y paralizaron transitoriamente, y la tráquea se intubó. El hematocrito, el nivel de hemoglobina, los índices de glóbulos rojos, el recuento de plaquetas y los resultados de las pruebas de función renal y hepática fueron normales, al igual que los niveles en sangre de fósforo, albúmina, globulina, amilasa y lipasa. Los resultados de las pruebas adicionales se muestran en la Tabla 1.
Una tomografía computarizada de la cabeza, obtenida sin la administración de material de contraste, no mostró una anomalía intracraneal aguda. También se obtuvieron imágenes de RMN de la cabeza sin la administración de material de contraste (Figura 1D, 1E y 1F). Las imágenes de FLAIR mostraron una hiperintensidad sulcal difusa que había aumentado desde el examen de RMN anterior. Las imágenes FLAIR también mostraron una anomalía de la señal difusa en el cerebelo y el borramiento de la folia cerebelosa, hallazgos compatibles con edema cerebeloso difuso. El borramiento difuso de los surcos había aumentado desde el examen de RMN anterior, y estaba presente un leve borramiento de las cisternas basales; estos hallazgos fueron consistentes con edema cerebral. La angiografía por resonancia magnética de la circulación intracraneal, realizada con el uso de una técnica de tiempo de vuelo tridimensional, no reveló una estenosis hemodinámicamente significativa. La RMN de la columna vertebral se realizó sin la administración de material de contraste. Las imágenes ponderadas en T2 mostraron una anomalía en la señal hiperintensa difusa, mal definida y una leve expansión de la médula espinal desde la unión cervicomedular hasta el cono medular (Figura 2A). Los cambios en la médula espinal son más prominentes en la sustancia gris central (Figura 2B).
Figura 2
Imágenes de RMN de columna vertebral.
La RMN de la columna cervical se realizó sin la administración de contraste. Una imagen ponderada en T2 muestra una hiperintensidad difusa, mal definida y una expansión leve de la médula espinal cervical (Panel A, flecha). Una imagen axial ponderada en T2 muestra que la anomalía de la señal en la médula espinal afecta predominantemente a la sustancia gris central (Panel B, flecha). La imagen de toda la columna vertebral reveló una afectación difusa de la médula espinal, con una anomalía en la señal que se extiende hacia abajo al nivel del cono medular (no se muestra).
Se colocaron un catéter arterial y un catéter central femoral derecho. Se administró una solución de manitol al 20% (25 g) por vía intravenosa; También se administraron ceftriaxona, vancomicina, aciclovir y azitromicina.
Se realizaron pruebas diagnósticas adicionales.
DIAGNÓSTICO DIFERENCIAL
Esta estudiante universitaria de 19 años, previamente sana, presumiblemente inmunocompetente, completamente inmunizada, se presentó con fiebre, estado mental alterado, signos meníngeos, debilidad proximal, ataxia y retención urinaria que se desarrolló durante un período de 7 días en el otoño en Massachusetts. Ella no había tenido exposiciones relacionadas con viajes, contacto con animales o insectos, o exposiciones dietéticas, aunque la historia puede ser limitada debido a su estado mental alterado. Una enfermedad diarreica había ocurrido 2 semanas antes de la presentación, posiblemente sugiriendo un proceso postinfeccioso.
El examen general reveló conjuntivitis, que puede ocurrir con infecciones virales del sistema nervioso central como el adenovirus y el virus del Nilo Occidental. Alternativamente, la inyección conjuntival puede indicar uveítis, que requiere un examen oftalmológico formal para la detección. La presencia de uveítis reduciría el diagnóstico diferencial a los síndromes uveomeníngeos. El dolor de garganta y la linfadenopatía cervical son hallazgos inespecíficos, pero podrían sugerir patógenos de las vías respiratorias superiores, como Mycoplasma pneumoniae o virus.
Los síntomas y signos neurológicos incluyen cambios en el estado mental, movimientos oculares anormales, debilidad proximal (con disminución del tono y aumento de los reflejos), ataxia troncal, nistagmo rotatorio y retención urinaria; el examen del tallo cerebral fue en gran parte normal y el examen de la sensibilidad no fue confiable. La paciente tenía movimientos oculares lentos hacia arriba (reverse ocular dipping), una condición asociada con disfunción cerebral difusa causada por encefalopatías metabólicas potencialmente reversibles o encefalitis infecciosas; ella no tenía movimientos oculares lentos hacia abajo (ocular bobbing), una condición asociada con daño pontino y pronóstico desfavorable.1 En general, los hallazgos neurológicos sugieren una localización multifocal que afecta de manera difusa a la corteza, el cerebelo y la médula espinal.
Las imágenes de resonancia magnética confirman la localización clínica y muestran una afectación medular adicional, que puede contribuir al estado mental alterado. El realce leptomeníngeo y el aumento de la señal sulcal en las imágenes FLAIR sugieren inflamación; el aumento del recuento de glóbulos blancos y el aumento del contenido de proteínas en las leptomeninges y el espacio subaracnoideo se confirman mediante el análisis del LCR. El borramiento de los surcos cerebrales y las cisuras cerebelosas sugiere un edema cerebral y cerebeloso difuso. La hiperintensidad espinal y medular sugiere inflamación. Los cambios en la médula espinal son más prominentes en la sustancia gris central, lo que podría sugerir una infección viral similar a la poliomielitis. En un huésped inmunizado, tales infecciones podrían incluir enterovirus y virus del Nilo occidental. Las anomalías de la sustancia blanca están notablemente ausentes en la resonancia magnética.
Los hallazgos de laboratorio incluyen hiponatremia y una tasa normal de sedimentación de eritrocitos. Las pruebas exhaustivas para enfermedades infecciosas fueron negativas.
MENINGOENCEFALOMIELITIS
La presentación del paciente es más consistente con la meningoencefalomielitis con una causa infecciosa o inflamatoria. El diagnóstico diferencial en este momento se describe en la Tabla 2.
TABLA 2
PRUEBAS DE DIAGNÓSTICO RECOMENDADAS.
CAUSAS INFECCIOSAS
Los resultados del Proyecto de Encefalitis de California pueden ayudar a enfocar la búsqueda de causas infecciosas. De los 1570 pacientes que participaron en el estudio publicado en 2006, se identificó una causa confirmada o probable de encefalitis en el 24% (la causa fue infecciosa en el 16% y no infecciosa en el 8%), se identificó una posible causa infecciosa en 13%, y no se identificó causa en el 63% restante. La causa más comúnmente identificada fue M. pneumoniae; Se consideró una causa posible y no una causa confirmada o probable en casi todos los casos. Las siguientes causas virales se identificaron en al menos el 1% de los pacientes: enterovirus, virus del herpes simple, virus varicela-zoster, virus del Nilo Occidental y virus de Epstein-Barr.
En este paciente, es notable que los eosinófilos representaron el 3% de las células en el LCR, pero la ausencia de eosinofilia periférica y factores de riesgo claros hace que la meningoencefalomielitis eosinofílica con una causa parasitaria sea un diagnóstico improbable.3 Muchas causas infecciosas se han eliminado en la base de los resultados de las pruebas disponibles. De las posibilidades restantes, M. pneumoniae es un contendiente fuerte. La edad del paciente se encuentra dentro del rango de edad de los 111 pacientes en el Proyecto de Encefalitis de California que recibieron un diagnóstico de encefalitis debido a la infección por M. pneumoniae.4 Entre esos pacientes, los síntomas gastrointestinales (como se ven en este paciente) fueron sorprendentemente tan comunes como los síntomas respiratorios. Sin embargo, los hallazgos de LCR y RMN de este paciente fueron más graves de lo que se esperaría con este diagnóstico.
El paciente tuvo una prueba de PCR negativa para el virus del Nilo Occidental, pero se deben realizar pruebas serológicas para este agente porque es más sensible. Existen varias características que podrían ser indicativas de infección por el virus del Nilo Occidental, incluida la debilidad focal, anomalías predominantes en la sustancia gris central en la RMN espinal 6 e hiponatremia. Sin embargo, las personas jóvenes inmunocompetentes tienden a no tener complicaciones neuroinvasivas de la infección por el virus del Nilo Occidental. Además, la época del año, la hiperreflexia y la ausencia de neutrófilos en el LCR no son compatibles con la infección por el virus del Nilo Occidental7,8.
CAUSAS NO INFECCIOSAS
La vasculitis de vasos pequeños del sistema nervioso central es una posible causa no infecciosa y requeriría una biopsia de cerebro para un diagnóstico definitivo. Sin embargo, las lesiones hiperintensas en la sustancia blanca se ven en las imágenes de resonancia magnética en casi todos los pacientes con vasculitis de vasos pequeños del sistema nervioso central, pero no se observaron en las imágenes de resonancia magnética de este paciente. Además, este paciente tenía muchas más células blancas en el LCR de lo que se esperaría con este diagnóstico.9,10
La presencia de encefalopatía y síntomas y signos neurológicos multifocales después de una infección sistémica podría sugerir una encefalomielitis diseminada aguda. Sin embargo, de acuerdo con la definición establecida en 2007 por el Grupo Internacional de Estudio de Esclerosis Pediátrica Múltiple, 11 pacientes deben tener lesiones hiperintensas multifocales en la sustancia blanca para recibir este diagnóstico. La presencia de realce leptomeníngeo puede argumentar contra un trastorno desmielinizante; de los 301 pacientes pediátricos con trastornos desmielinizantes adquiridos que participaron en un estudio prospectivo canadiense, solo hubo un aumento de 12 leptomeníngeos en el 3%. También debe considerarse la neuromielitis óptica. Los pacientes con neuromielitis óptica pueden presentar mielitis extensa longitudinalmente sin neuritis óptica, y puede haber compromiso cerebral con encefalopatía, particularmente en pacientes más jóvenes.13 Además, los pacientes con neuromielitis óptica son más propensos que los pacientes con otros trastornos desmielinizantes a tener eosinófilos en el LCR .14 Sin embargo, el realce leptomeníngeo extenso rara vez se describe con la neuromielitis óptica y, por lo tanto, la neuromielitis optica es un diagnóstico poco probable en este caso.
ENCEFALITIS POR M. PNEUMONIAE
Sobre la base de la epidemiología de la encefalitis en los Estados Unidos y la edad de este paciente, el diagnóstico más probable es la encefalitis por infección por M. pneumoniae. Sin embargo, hay varias advertencias. Este diagnóstico a menudo se realiza sobre la base de los resultados de las pruebas serológicas, pero estas pruebas tienen una especificidad deficiente, particularmente cuando se usan métodos más antiguos, como la fijación del complemento.15 En un estudio que evalúa ocho pruebas serológicas disponibles comercialmente: ensayos de aglutinación de partículas, inmunoensayos enzimáticos y ensayos inmunoabsorbentes ligados a enzimas (ELISA, por sus siglas en inglés): al menos el 20% de los niños, adolescentes y adultos jóvenes israelíes que participaron en el estudio tuvieron pruebas positivas de anticuerpos IgM contra M. pneumoniae, a pesar de que no habían tenido enfermedad febril en las 2 a 4 semanas anteriores.16 Después de una infección conocida con M. pneumoniae, los títulos de anticuerpos pueden tardar semanas o meses en normalizarse.15 Además, las pruebas realizadas para la detección de M. pneumoniae en muestras respiratorias no pueden distinguirse entre una infección aguda , infección convaleciente, y portador asintomático. Los ensayos de PCR detectaron M. pneumoniae en el LCR en solo el 2% de los 111 pacientes del Proyecto de Encefalitis de California que recibieron un diagnóstico de encefalitis asociada con M. pneumoniae .4 Por lo tanto, se deben considerar otros diagnósticos incluso cuando un paciente con encefalitis tiene un Test positivo para anticuerpos contra M. pneumoniae.
De hecho, 4 de los 10 pacientes del Proyecto de Encefalitis de California que finalmente recibieron un diagnóstico de encefalitis asociada con anticuerpos contra el receptor anti-N-metil-D-aspartato (NMDA) (una vez testeados para anticuerpos contra el receptor anti-NMDA una vez que estos estuvieran disponibles), tenía pruebas positivas para anticuerpos contra M. pneumoniae y había recibido un diagnóstico de encefalitis asociada a M. pneumoniae.17 La encefalitis por anticuerpos anti-receptor de NMDA es un diagnóstico muy poco probable en esta paciente, porque no tuvo convulsiones ni un trastorno del movimiento y los hallazgos de la RMN fueron mucho más extensos que los que se observan normalmente en los pacientes con este diagnóstico.
En una revisión de 2010 de casos previamente publicados de enfermedad del sistema nervioso central asociada con M. pneumoniae, los autores informaron la detección de M. pneumoniae en tejido cerebral en 3 pacientes (2 con encefalitis y 1 con encefalomielitis diseminada aguda) y en el LCR en aproximadamente 50 pacientes, con el uso de cultivo o PCR; estos hallazgos sugieren la posibilidad de una infección por M. pneumoniae directa del sistema nervioso central. Además, se detectaron anticuerpos anti-galactocerebrosido (GalC) en la sangre, el LCR o ambos (con el uso de ELISA) en algunos pacientes con encefalitis asociada a M. pneumoniae, particularmente en aquellos con evidencia de desmielinización en la RMN. 18 Los anticuerpos anti-GalC se pueden inducir a través del mimetismo molecular entre GalC en mielina y epítopes en M. pneumoniae.18 Por lo tanto, M. pneumoniae puede ser importante en la patogenia de algunos casos de encefalitis, incluso cuando el sistema nervioso central no es directamente infectado.
Para determinar el diagnóstico en este paciente, realizaría pruebas adicionales, que se resumen en la Tabla 2. Mientras esperaba los resultados de la prueba, brindaría atención de apoyo, incluida la gestión de las vías respiratorias y el mantenimiento de la temperatura corporal normal y los niveles de glucosa y sodio. Clínicamente evidente, el aumento de la presión intracraneal debe manejarse con atención al equilibrio de líquidos y sodio y con una infusión de manitol o solución salina hipertónica. Aunque los agentes antimicrobianos de amplio espectro están inicialmente indicados, estos pueden suspenderse si el paciente tiene pruebas negativas para enfermedades infecciosas. La azitromicina es una opción de tratamiento razonable para una posible infección por M. pneumoniae, aunque no hay pruebas claras de su beneficio en la enfermedad del sistema nervioso central.
Dos preguntas importantes permanecen con respecto al diagnóstico y tratamiento de este paciente. Primero, ¿debería realizarse una biopsia leptomeníngea y cerebral para evaluar la vasculitis de vasos pequeños del sistema nervioso central? Este diagnóstico es cada vez más reconocido y requeriría un régimen de tratamiento intensivo que de otro modo no se prescribiría, pero no recomendaría una biopsia en este caso debido a los hallazgos atípicos de RMN y LCR. En segundo lugar, ¿deberían administrarse los glucocorticoides como tratamiento empírico para un posible trastorno autoinmune del sistema nervioso central o como un tratamiento complementario, en combinación con antimicrobianos, para una posible encefalitis infecciosa? Hay efectos adversos conocidos de los glucocorticoides, y se ha expresado la preocupación de que podrían retrasar la eliminación de los agentes infecciosos19. Sin embargo, los datos sobre la encefalitis asociada con el virus del herpes simple sugieren un beneficio para la administración de glucocorticoides en combinación con aciclovir19,20. De la falta de evidencia, la decisión de administrar glucocorticoides se toma caso por caso y debe tener en cuenta la gravedad de la enfermedad, las afecciones asociadas y la contribución relativa estimada de los mecanismos infecciosos e inflamatorios directos. En este paciente, administraría metilprednisolona (a una dosis de 30 mg por kilogramo por día, con una dosis máxima de 1 g por día) durante 5 días, con un control cuidadoso, aunque reconozco la falta de pruebas definitivas publicadas para este enfoque.
DIAGNOSTICO CLINICO
MENINGOENCEFALOMIELORADICULITIS PARAINFECCIOSA, POSIBLEMENTE DEBIDO A MYCOPLASMA PNEUMONIAE Y MENOS PROBABLE DEBIDO AL VIRUS DEL NILO OCCIDENTAL.
DISCUSION PATOLOGICA
Actualmente, no hay una sola prueba de laboratorio con suficiente sensibilidad y especificidad para establecer el diagnóstico de una enfermedad del sistema nervioso central asociada con la infección por micoplasma. 21 En última instancia, este diagnóstico se basa en estudios de laboratorio, una presentación clínica compatible, características de neuroimagen compatibles y una evaluación de laboratorio negativa para causas infecciosas alternativas.
La interpretación de las pruebas serológicas para M. pneumoniae se complica tanto por la persistencia de anticuerpos contra M. pneumoniae después de la infección como por la sensibilidad y especificidad imperfectas de los ensayos disponibles. La respuesta del anticuerpo IgM alcanza un pico aproximadamente 3 semanas después de la infección y luego comienza a disminuir, pero puede persistir durante varios meses. Dado que las pruebas de anticuerpos IgM contra M. pneumoniae pueden tener resultados falsos negativos y falsos positivos, el diagnóstico serológico es más confiable cuando el título de anticuerpos IgG en una muestra de suero en fase convaleciente es cuatro veces más alto que el título de anticuerpos IgG en una fase aguda En fase de muestra de suero. 22,23
Las muestras de suero recogidas de esta paciente los días 9 y 13 de su enfermedad dieron positivo para anticuerpos IgM contra M. pneumoniae; estos hallazgos son consistentes con una infección reciente. En un espécimen recolectado el día 75 de su enfermedad, los anticuerpos IgM permanecieron detectables por inmunoensayo enzimático, pero un ensayo de inmunofluorescencia indirecta confirmatorio fue negativo para anticuerpos IgM, lo que sugiere una disminución en la respuesta del anticuerpo IgM. Las pruebas en Las tres muestras(recolectados en los días 9, 13 y 75 de su enfermedad), para detectar anticuerpos IgG fueron positivos, y as tres muestras tuvieron valores de índice similares. Es difícil sacar conclusiones sobre el momento de la infección basándose en estos valores de índice por varias razones. Primero, las muestras de fase aguda y fase de convalecencia pueden haberse recolectado demasiado separadas para mostrar el pico de respuesta de anticuerpos. En segundo lugar, las muestras se analizaron de forma independiente en lugar de en paralelo, y como los valores del índice no están directamente relacionados con los niveles de anticuerpos, los resultados de las pruebas separadas no se pueden comparar directamente.
Otro factor a considerar en la interpretación de los resultados de las pruebas serológicas de este paciente es la administración de inmunoglobulina intravenosa (IGIV) en los días 13 a 17 de su enfermedad. Cada dosis de IVIG se deriva del plasma de miles de donantes y, por lo tanto, puede contener anticuerpos que son específicos para los agentes infecciosos.24 Después de considerar la vida media de la IVIG, creo que es probable que los anticuerpos del donante en la IVIG afecten la prueba los resultados se obtuvieron el día 75, pero la interpretación habría sido más difícil si las pruebas serológicas de fase convaleciente se hubieran intentado en un momento anterior, más convencional.
La prueba de PCR para M. pneumoniae se realizó en una muestra de LCR recolectada el día 21 de la enfermedad del paciente y fue negativa. Los resultados de las pruebas de PCR del LCR para M. pneumoniae han sido inconsistentes entre los pacientes con enfermedad del sistema nervioso central que se atribuye a la infección por micoplasma, incluso cuando la prueba se realiza al inicio del curso clínico25-27. La prueba de PCR para M. pneumoniae en LCR no está ampliamente disponible, aunque algunas instituciones y laboratorios de referencia ofrecen ensayos que no han sido aprobados por la FDA. Las características de rendimiento de estos ensayos varían, y se desconoce el estándar de referencia con el que deben compararse.
La paciente tuvo una evaluación de laboratorio extensa y no reveladora para las causas alternativas de su enfermedad. Las pruebas de anticuerpos y de amplificación de ácido nucleico para el virus de inmunodeficiencia humana fueron negativas, al igual que las pruebas de anticuerpos séricos para los arbovirus (incluido el virus La Crosse, el virus de la encefalitis equina occidental, el virus de la encefalitis de San Luis, el virus de la encefalitis equina del este y el virus del Nilo Occidental), sífilis, y una prueba de PCR en LCR para el virus varicela-zoster. Los resultados de las pruebas serológicas para el virus de Epstein-Barr, Bartonella henselae y B. quintana no fueron compatibles con una infección reciente.
En conjunto, los hallazgos clínicos y de neuroimagen compatibles, los resultados de las pruebas serológicas y la extensa evaluación negativa de laboratorio para las causas infecciosas alternativas son indicativos más probables de un diagnóstico de encefalomielitis parainfecciosa asociada con la infección por M. pneumoniae.
Una vez que recibimos los resultados de la prueba de anticuerpos contra el micoplasma, se administró levofloxacina. Otros agentes antibióticos ya habían sido descontinuados. Se administraron glucocorticoides adyuvantes de dosis altas para la presunta inflamación parainfecciosa del sistema nervioso central. A pesar de la administración de glucocorticoides intravenosos, se desarrolló una paraplejía flácida grave; la paciente tenía un estado de alerta mínimo y no podía seguir las órdenes incluso cuando ella no estaba recibiendo sedantes.
Debido a la gravedad de las deficiencias clínicas de la paciente y las anomalías difusas en su resonancia magnética, se administró un ensayo de IGIV para la encefalomielitis parainfecciosa severa refractaria a los glucocorticoides. Esta estrategia de tratamiento se basó en gran medida en la evidencia anecdótica porque, por lo que sabemos, ningún ensayo clínico ha determinado el tratamiento adecuado para esta enfermedad. Su condición comenzó a mejorar después de que recibió la IGIV; la mejoría podría deberse al tratamiento con IGIV, los efectos tardíos del tratamiento con glucocorticoides o la historia natural de la enfermedad. Parte de la literatura reporta un empeoramiento de los síntomas después de la interrupción de los glucocorticoides, y la paciente tuvo parestesias recurrentes después de que los glucocorticoides hubieran disminuido; por lo tanto, el estrechamiento del tratamiento con glucocorticoides se alargó.
La gastrostomía y la traqueostomía se realizaron para cuidados de apoyo. La paciente se sometió a una terapia física agresiva, y su estado mental y fuerza mejoraron constantemente. Diez semanas después de la admisión, tenía moderada debilidad asimétrica y clonus, pero caminaba con muletas. Dieciocho semanas después de la admisión, ella estaba viviendo con sus padres y tomando clases en una universidad local. Tenía que estudiar más de lo que estaba acostumbrada y estaba frustrada con lo que percibía como habilidades cognitivas disminuidas, pero estaba recibiendo una A en sus cursos.
Actualmente, la paciente está de vuelta en la universidad a tiempo completo. Le pediré que comparta su experiencia con el público.
La Paciente: “Aunque esta discusión fue sobre lo que me había sucedido, fue un poco extraño escuchar acerca de la peor parte de mi enfermedad, porque no tengo recuerdos de ella. Puedo decir con confianza que los recuerdos de mis padres y probablemente también los de mis médicos sobre mi caso son mucho peores que los que tengo. Para mí, el progreso de un bebé de 20 años a un adulto joven competente fue, y sigue siendo, un proceso increíblemente humillante. Mis recuerdos son principalmente los desafíos diarios que tuve, desde encontrar un medio para comunicarme cuando tuve una traqueotomía hasta recuperar mi fuerza y volver a aprender a caminar. Sin embargo, estos obstáculos nunca parecían insuperables con el constante estímulo de mi enorme grupo de apoyo, que incluía a mi familia, médicos, terapeutas, enfermeras y amigos. Es a estas personas, y al arduo trabajo que han invertido en mi bienestar, que debo el éxito de mi recuperación.
Como aspiro a ser médico algún día (el hecho de que primero fuera el paciente no estaba incluido en mi plan), estoy agradecida por haber podido experimentar de primera mano la perspectiva del paciente. Nunca olvidaré sentir la satisfacción de lograr metas pequeñas y el extenso amor y apoyo que sentí de todos los que me rodean.”
DIAGNÓSTICO PATÓGICO
ENCEFALOMIELITIS PARAINFECCIOSA ASOCIADA A INFECCIÓN SISTÉMICA POR MICOPLASMA.
Traducción de
A 19-Year-Old Womanwith Headache, Fever, Stiff Neck, and Mental-Status Changes
Mark P. Gorman, M.D., Sandra P. Rincon, M.D., and Virginia M. Pierce, M.D.
Referencias
1. Mehler MF. The clinical spectrum
of ocular bobbing and ocular dipping.
J Neurol Neurosurg Psychiatry 1988;51:
725-7.
2. Glaser CA, Honarmand S, Anderson
LJ, et al. Beyond viruses: clinical profiles
and etiologies associated with encephalitis.
Clin Infect Dis 2006;43:1565-77.
3. Graeff-Teixeira C, da Silva AC, Yoshimura
K. Update on eosinophilic meningoencephalitis
and its clinical relevance.
Clin Microbiol Rev 2009;22:322-48.
4. Christie LJ, Honarmand S, Talkington
DF, et al. Pediatric encephalitis: what is
the role of Mycoplasma pneumoniae?
Pediatrics 2007;120:305-13.
5. Leis AA, Stokic DS. Neuromuscular
manifestations of West Nile virus infection.
Front Neurol 2012;3:37.
6. Petropoulou KA, Gordon SM, Prayson
RA, Ruggierri PM. West Nile virus meningoencephalitis:
MR imaging findings.
AJNR Am J Neuroradiol 2005;26:1986-95.
7. Tyler KL, Pape J, Goody RJ, Corkill M,
Kleinschmidt-DeMasters BK. CSF findings
in 250 patients with serologically confirmed
West Nile virus meningitis and
encephalitis. Neurology 2006;66:361-5.
8. Gyure KA. West Nile virus infections.
J Neuropathol Exp Neurol 2009;68:1053-
60.
9. Salvarani C, Brown RD Jr, Calamia
KT, et al. Primary central nervous system
vasculitis: analysis of 101 patients. Ann
Neurol 2007;62:442-51.
10. Hutchinson C, Elbers J, Halliday W,
et al. Treatment of small vessel primary
CNS vasculitis in children: an open-label
cohort study. Lancet Neurol 2010;9:1078-
84. [Erratum, Lancet Neurol 2010;9:1045.]
11. Krupp LB, Banwell B, Tenembaum S.
Consensus definitions proposed for pediatric
multiple sclerosis and related disorders.
Neurology 2007;68:Suppl 2:S7-S12.
12. O’Mahony J, Bar-Or A, Arnold DL,
Sadovnick AD, Marrie RA, Banwell B.
Masquerades of acquired demyelination
in children: experiences of a national
demyelinating
disease program. J Child
Neurol 2013;28:184-97.
13. Lotze TE, Northrop JL, Hutton GJ,
Ross B, Schiffman JS, Hunter JV. Spectrum
of pediatric neuromyelitis optica.
Pediatrics 2008;122(5):e1039-e1047.
14. Jarius S, Paul F, Franciotta D, et al.
Cerebrospinal fluid findings in aquaporin-
4 antibody positive neuromyelitis
optica:
results from 211 lumbar punctures.
J Neurol Sci 2011;306:82-90.
15. Bitnun A, Richardson SE. Mycoplasma
pneumoniae: innocent bystander or a true
cause of central nervous system disease?
Curr Infect Dis Rep 2010;12:282-90.
16. Nir-Paz R, Michael-Gayego A, Ron M,
Block C. Evaluation of eight commercial
tests for Mycoplasma pneumoniae antibodies
in the absence of acute infection.
Clin Microbiol Infect 2006;12:685-8.
17. Gable MS, Gavali S, Radner A, et al.
Anti-NMDA receptor encephalitis: report
of ten cases and comparison with viral
encephalitis. Eur J Clin Microbiol Infect
Dis 2009;28:1421-9.
18. Christie LJ, Honarmand S, Yagi S,
Ruiz S, Glaser CA. Anti-galactocerebroside
testing in Mycoplasma pneumoniae-associated
encephalitis. J Neuroimmunol 2007;
189:129-31.
19. Fitch MT, van de Beek D. Drug insight:
steroids in CNS infectious diseases
— new indications for an old therapy. Nat
Clin Pract Neurol 2008;4:97-104.
20. Martinez-Torres F, Menon S, Pritsch M,
et al. Protocol for German trial of Acyclovir
and corticosteroids in Herpes-simplexvirus-
encephalitis (GACHE): a multicenter,
multinational, randomized, double-blind,
placebo-controlled German, Austrian and
Dutch trial. BMC Neurol 2008;8:40.
21. Mycoplasma pneumoniae and other
Mycoplasma species infections. In: Pickering
L, Baker CJ, Kimberlin DW, Long SS,
eds. Red Book: 2012 report of the
Committee on Infectious Diseases. 29th
ed. Elk Grove Village, IL: American
Academy of Pediatrics, 2012:518-21.
22. Waites K, Taylor-Robinson D. Mycoplasma
and ureaplasma. In: Versalovic J,
Carroll KC, Funke G, Jorgensen JH,
Landry ML, Warnock DW, eds. Manual of
clinical microbiology. 10th ed. Washington,
DC: ASM Press, 2011:970-85.
23. Tunkel AR, Glaser CA, Bloch KC, et al.
The management of encephalitis: clinical
practice guidelines by the Infectious
Diseases Society of America. Clin Infect
Dis 2008;47:303-27.
24. Csángó PA, Pedersen JE, Hess RD.
Comparison of four Mycoplasma pneumoniae
IgM-, IgG- and IgA-specific enzyme
immunoassays in blood donors and
patients. Clin Microbiol Infect 2004;10:
1094-8.
25. Fink CG, Sillis M, Read SJ, Butler L,
Pike M. Neurological disease associated
with Mycoplasma pneumoniae infection:
PCR evidence against a direct invasive
mechanism. Clin Mol Pathol 1995;48:
M51-4.
26. Socan M, Ravnik I, Bencina D, Dovc P,
Zakotnik B, Jazbec J. Neurological symptoms
in patients whose cerebrospinal
fluid is culture- and/or polymerase chain
reaction-positive for Mycoplasma pneumoniae.
Clin Infect Dis 2001;32(2):
E31-E35.
27. Narita M, Yamada S. Two distinct
patterns of central nervous system complications
due to Mycoplasma pneumoniae
infection. Clin Infect Dis 2001;
33:916-7.