Un varón de 23 años fue internado por tos, ronquera, fiebre, y alteraciones en la radiografía de tórax.
El paciente había estado bien hasta 1 mes antes de la internación cuando comenzó con tos no productiva. Durante todo el mes tuvo sensación de fiebre, sobre todo por la noche sin sudoración; no se tomó la temperatura. Una semana antes de la internación comienza con ronquera asociada a mialgias y disnea de esfuerzo. Dos noches antes de la internación la temperatura subió a 38,9 °C con sudoración nocturna. A la mañana siguiente vio a su médico. El paciente no tenía cefalea, dolor de garganta, expectoración, dolor torácico, palpitaciones, hemorragias o púrpura, cambios en el apetito, ni síntomas visuales, abdominales, urinarios o neurológicos. Una radiografía de tórax mostró una masa hiliar y mediastinal, por lo que se envió al departamento de emergencias.
En el examen, al paciente se lo veía bien. La presión arterial era de 139/84 mm Hg, el pulso 129 por minuto, la temperatura de 36,6°C, la frecuencia respiratoria de 24 por minuto y la saturación de oxígeno de 97% mientras respiraban aire ambiente. El peso era de 81,2 kg y la altura de 193 cm. Un nódulo móvil de 1 a 2 mm de diámetro estaba presente en la región posterior del testículo derecho que se interpretó como un quiste de epidídimo; el resto del examen físico era normal. El nivel de fosfatasa alcalina sérica era de 294 U/litro (valor de referencia de 110 a 225); los niveles de alfa fetoproteína, gonadotrofina coriónica humana, electrolitos, glucosa, amilasa, lipasa, ácido úrico, magnesio, proteínas totales, y albúmina, y tests de función hepática y renal fueron normales. Un test para antígeno estreptocóccico y para mononucleosis infecciosa fueron negativos, en faringe así como los anticuerpos y antígenos para virus de Epstein-Barr. El recuento de plaquetas fue de 521.000/mm3, y el resto del laboratorio estaba normal. El tiempo de tromboplastina parcial era de 41,5 seg (normal 23,3 a34,5), el tiempo de protrombina de 16,8 seg (normal12,8 a 15), y el RIN, de 1,3 (normal de 0,9 a 1,1).
Una radiografía de tórax reveló linfadenopatías hiliares y mediastinales y densidades ovoideas en el vértice derecho y el segmento superior del lóbulo inferior izquierdo.
Fue internado.
Al día siguiente se realizó una TC de tórax con administración de contraste EV, la cual reveló una gran masa confluente de mediastino y ganglios hiliares bilaterales, masas en el vértice derecho (de 3,5 cm por 2,8 cm de diámetro), segmento superior del lóbulo inferior izquierdos (de 3,6 cm de diámetro), y masas en el lóbulo inferior izquierdo que se extendían hasta el hilio izquierdo. La TC de abdomen y pelvis después de la administración de contraste mostró lesiones líticas destructivas en el hueso ilíaco posterior derecho.
Una ecocardiografía transtorácica fue normal. El electrocardiograma mostró taquicardia sinusal (132 por minuto) y fue por otro lado normal. Se llevó a cabo una mediastinoscopía con biopsia de ganglios mediastinales.
El paciente había perdido 4,5 kg de peso sin realizar ninguna dieta durante los últimos 2 meses. Un mes antes de la internación, su médico de cabecera había palpado una masa en testículo derecho, y 12 días antes de la internación una ultrasonografía mostró un quiste de epidídimo derecho e hidrocele. El paciente estaba circuncidado 5 años antes por fimosis. No tomaba medicamentos y era alérgico a la meperidina. Era un estudiante y vivía con su compañero de cuarto en una granja. Estaba expuesto a vacas, caballos y perros. Tomaba alcohol ocasionalmente, no fumaba ni utilizaba drogas ilícitas. No había antecedentes de viajes recientes; su compañero de cuarto había viajado recientemente a España y tenía enfermedad respiratoria con tos, fiebre y dolor de garganta. Sus padres y dos hermanas estaban en buen estado de salud; su abuela materna había muerto a los 67 años de cáncer de pulmón, una tía paterna había muerto a los 25 años de fibrosarcoma, y una tía materna tenía sarcoidosis.
En el examen el paciente impresionaba enfermo, estaba adelgazado; su voz era ronca. La temperatura de 36,4°C, el pulso de 107 por minuto, y la frecuencia respiratoria de 18 por minuto, la saturación de oxígeno de 96% mientras respiraba aire ambiente. El resto del examen era normal. La fosfatasa alcalina era de 253 U/litro (normal (45 a 115), y la láctico deshidrogenasa (LDH), de 616 U por litro (normal 110 a 210). El recuento de plaquetas era de 644.000/mm3 (normal 150.000 a 400.000). El resultado del resto de los análisis de laboratorio eran normales.
Al día siguiente, la temperatura subió a 39,3°C; se le administró acetaminofén. Los hemocultivos eran estériles, y en la orina desarrolló un estafilococo poco común. Una Rx de tórax obtenida el cuarto día de internación no mostró cambios en las masas hiliares y mediastinales, y no había evidencias de neumonía. Un test de screening para tuberculosis fue negativo.
El quinto día de internación una tomografía por emisión de positrones (PET) con 18F-fluorodeoxiglucosa (18F-FDG), y TC de tórax abdomen y pelvis fue llevada a cabo después de la administración de contraste EV. El scan mostró múltiples lesiones ávidas de 18F-FDG en tórax, incluyendo las masas en lóbulo inferior izquierdo (4,3 x 2,6), superficie pleural posterior izquierda (3,7 x 1,7 cm), lóbulo superior derecho (3,6 x 2,2 cm), y ápex posterior derecho (0,8 cm de diámetro), y las masas mediastinales e hiliares notadas previamente; una masa de consistencia de partes blandas con avidez por 18F-FDG y realce heterogéneo (7,3 x 4,7 cm) que obliteraba la parte posterior del ílion derecho e infiltraba la parte superior de la articulación sacroilíaca derecha; y lesiones ávidas de 18F-FDG a lo largo de toda la espina lumbar, acetábulo y pubis. No había evidencias de fracturas patológicas. Un test para HIV fue negativo.
El sexto día se realizó una biopsia ganglionar mediastinal toracoscópica que fue diagnóstica.
Diagnóstico Diferencial.
El elemento clave en este caso son las adenomegalias mediastinales, las múltiples masas pulmonares y una gran lesión ósea pélvica destructiva en un hombre joven. Otro importante elemento a considerar en este caso, es el relativo buen estado general a pesar de la extensión del proceso, niveles normales de alfa-fetoproteína y sub unidad beta de la gonadotrofina coriónica humana y el elevado nivel de LDH y fosfatasa alcalina.
Imágenes.
La Rx de tórax frente y perfil (Figuras 1A y 1B), muestran una masa en el vértice derecho junto a ensanchamiento mediastinal e hilios prominentes. En la radiografía de perfil hay también una masa en el segmento superior del lóbulo inferior izquierdo (Figura 1B). Las imágenes del PET-TC, revelaron una masa lobulada en el vértice del pulmón derecho (Figura 2) y una masa lobulada en el segmento superior del lóbulo inferior izquierdo. Hay también linfadenopatías bulky mediastinales y bilaterales. Las áreas de baja densidad en las masas ganglionares corresponden a necrosis. Hay una evidente captación de 18F-FDG.
Figura 1. Radiografía De tórax.
Una radiografía de frente (Panel A), muestra una masa apical (flecha negra), y masas hiliares bilaterales (flechas blancas). Una radiografía de perfil (Panel B) muestra una masa en el segmento superior del lóbulo inferior (flecha negra) y masas hiliares y mediastinales (flechas blancas).
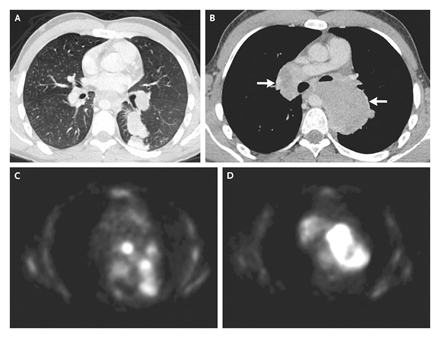
Figura 2. Combinación de PET-TC de tórax.
Una TC axial con ventana para pulmón (Panel A), de una combinación de PET-TC, muestra una masa en el segmento superior del lóbulo inferior izquierdo. Una TC con ventana para partes blandas (Panel B) muestra adenomegalias bulky bilaterales hiliares y subcarinales (flechas9). Hay aumento de la captación de 18F-fluorodeoxiglucosa en el correspondiente PET (Paneles C y D).
En el hueso ilíaco derecho (Figura 3) hay una gran lesión osteolítica con un componente de partes blandas que muestra realce en el PET. La zona de transición está ensanchada lo cual es sugestivo de lesión agresiva. No hay calcificación ni osificación de la matriz, que sugiera un proceso formador de hueso o cartílago. Hay también unas pocas lesiones osteolíticas en otros huesos. Todas las lesiones óseas revelan captación de 18F-FDG aumentada en el PET, hallazgo sugestivo de proceso hipermetabólico.
Figura 3. Combinación de PET-TC de pelvis.
La TC con ventana para partes blandas (Panel A) y hueso (Panel B), muestra una gran lesión lítica en el hueso ilíaco derecho con una masa de partes blandas asociada. No hay osificación ni calcificación. Un PET (Panel C) muestra aumento de la captación de 18F-fluorodeoxiglucosa en el hueso ilíaco derecho en el área correspondiente a la lesión.
Cuál es el diagnóstico?
Los diagnósticos diferenciales de linfadenopatías mediastinales, lesiones pulmonares y lesiones pélvicas tomados en forma separada, son amplios e incluyen condiciones no malignas y malignas, pero tomados juntos esta constelación de hallazgos son casi definitivamente expresión de un proceso maligno.
Tumores Malignos.
Dado que la mayoría de las masas grandes bilaterales pulmonares son causadas por enfermedad metastásica tanto el mediastino como los huesos pélvicos son candidatos a ser los sitios primarios de la neoplasia maligna.
Un linfoma de alto grado originado tanto en mediastino como en hueso debe ser fuertemente considerados en este paciente. El paciente llevaba sólo dos días de fiebre y sudoración nocturna, y sólo una modesta pérdida de peso, pero aun los linfomas avanzados pueden no tener síntomas muy prominentes.
Los linfomas que suelen presentarse como una gran masa mediastinal en adultos jóvenes incluyen el linfoma mediastínico primario de células B grandes, el linfoma linfoblástico de células T, y el linfoma de Hodgkin clásico variedad esclerosis nodular. Los linfomas primarios difusos de células B grandes de hueso con diseminación a los ganglios mediastínicos y pulmón, las kinasa de linfoma anaplásico (ALK), los linfomas de células grandes positivos anaplásicos y el linfoma de Burkitt deben ser considerados.
Además de los linfomas deben considerarse los tumores de células germinales cuando se ven linfadenopatías en un varón joven, especialmente porque los tumores germinales son tumores sólidos relativamente tratables, aun en estadios avanzados. Es importante notar que los niveles normales de sub unidad beta de la hCG, y la alfa-fetoproteína no debe ser motivo para que se interrumpa la búsqueda de estos tumores. Los niveles de alfa-fetoproteína no están típicamente elevados en los tumores de células germinales seminomatosos, y pueden ser normales en 20% de los tumores germinales no-seminomatosos. Los niveles de la subunidad beta de la hCG son normales en 90% de los tumores de células germinales seminomatosos, y pueden ser normales en 65 a 70% de los no-seminomatosos. (1) Las metástasis a hueso son más características de los tumores de células germinales seminomatosos que de los no seminomatosos. Por lo tanto, con compromiso óseo, y niveles normales de alfa-fetoproteína y subunidad de hCG, el diagnóstico de tumor germinal seminomatoso, también conocido como germinoma sería más probable que el de tumor germinal no-seminomatoso.
El primer y segundo tumores malignos de hueso son el osteosarcoma y el sarcoma de Ewing respectivamente. Otros tumores malignos de hueso menos comunes incluyen el linfoma primario de hueso, el sarcoma pleomórfico indiferenciado o sarcoma de células fusiformes, el condrosarcoma, el cordoma y el tumor de células gigantes de hueso. Las metástasis a los ganglios mediastínicos sería un hallazgo atípico de todos esos tumores óseos primarios, aunque los casos de sarcoma de Ewing con compromiso mediastinal está descripto.
Dado que las metástasis pulmonares son más comunes que las metástasis a huesos de la pelvis, el primer diagnóstico a considerar sería un tumor maligno primario de hueso, de los cuales el osteosarcoma y el sarcoma de Ewing son los más probables. De los dos, las metástasis a los ganglios mediastinales, la enfermedad ósea de comienzo primario en el hueso ilíaco, y la falta de osificación vista en el sitio primario, apunta a sarcoma de Ewing
Discusión patológica.
En el ganglio obtenido por biopsia toracoscópica, había una alteración de la estructura del ganglio producida por una población monomorfas de células pequeñas redondas con cromatina fina y nucléolos no llamativos y con escaso citoplasma (Figura 4A). Las células tumorales fueron identificadas dentro del seno subcapsular (Figura 4A inserto). Estos hallazgos son consistentes con aquellos diagnósticos que incluyen los tumores de células azules, pequeñas y redondas. El diagnóstico diferencial incluye el linfoma sarcoma de Ewing, el rabdomiosarcoma, el neuroblastoma, el tumor de células germinales, el carcinoma de células pequeñas desmoplásico, y el sarcoma sinovial indiferenciado. El sarcoma de Ewing raramente puede dar metástasis ganglionares.
Figura 4. Biopsia de ganglio mediastínico.
El tumor está compuesto por una población monomorfa de células pequeñas, redondas (Panel A hematoxilina-eosina), con cromatina fina, nucléolos no prominentes, y citoplasma escaso. Las células tumorales están presentes dentro de la cápsula del ganglio (inserto, cabezas de flecha), y el seno subcapsular (inserto, flechas). La tinción inmunohistoquímica de las células tumorales fue fuertemente positiva para CD99 (Panel B) y FLI1 (Panel C). El análisis de hibridización por fluorescencia in situ con el uso de sonda (Panel D) reveló reordenamiento del locus EWS (círculo) y no-reordenamiento del locus EWS (flecha)
La tinción inmunohistoquímica del tumor mostró una expresión difusa de CD99 y FLI 1 (Figura 4B y 4C) y fue negativa para marcaadores linfoides (deoxinucleotil transferasa terminal, CD20, PAX5,CD2y CD7), citoqueratina, fosfatasa alcalina placentaria, CD34, y marcadores musculares (desmina, miogenina, y mioD1). La citometría de flujo no reveló evidencias de población monotípica B, y una población de células T fenotípicamente anormal o población blástica. La hibridización in situ llevada a cabo en tejidos embebidos en formalina con el uso de sondas reveló un reordenamiento del gen EWS en las células tumorales (Figura 4D).
El reordenamiento del locus EWS ocurre en muchos tumores, incluyendo condrosarcomas mixoides extraesqueléticos, tumor de células redondas desmoplásico, sarcoma de Ewing, sarcoma de células claras, histiocitoma fibroso y raramente el liposarcoma mixoide. En el sarcoma de Ewing hay 5 potenciales pares de fusiones: FLI1, ERG, ETV1, E1AF, y FEV. De los sarcomas de Ewing, 85 a 90% tienen reordenamientos EWS-FLI, 10 a 15% tienen reordenamientos EWS-ERG, y menos de 1% tienen reordenamientos con la fusión del otro par. (2,3) La sonda usada en este ensayo no reveló fusión de pares. En este caso, la combinaciónde hallazgos morfológicos, el inmunofenotipo, y el reordenamiento del locus EWS son diagnósticos de sarcoma de Ewing.
Discusión del manejo.
Este joven tiene un tumor pélvico muy grande metastizado a mediastino y ambos pulmones. A pesar de lo avanzado de la enfermedad el paciente estaba casi asintomático hasta pocos días antes de consultar y su único marcador de laboratorio fue una elevación de la LDH (un marcador de turnover o recambio celular). Tal discordancia entre la extensión de la enfermedad y los síntomas clínicos no son usuales para un paciente con sarcoma de Ewing. Las metástasis se encuentran sincrónicamente con el diagnóstico del tumor en 25% de los casos. (11)
Confirmación del diagnóstico.
El paso inicial en el manejo del sarcoma de Ewing matestásico es confirmar el diagnóstico discutiendo con el patólogo si el tejido provisto es suficiente para proveer un diagnóstico definitivo. El diagnóstico no debe basarse sólo en hallazgos morfológicos, y deben ser revisados por un patólogo experimentado en tumores musculoesqueléticos, y la biopsia debe ser repetida si la cantidad de tejido es inadecuada para un diagnóstico completo.
Estadificación.
El paso siguiente es determinar la extensión de la enfermedad ya que esto puede afectar el pronóstico. Una Rx de tórax, una TC, y una RMN del tumor primario pueden contribuir a dar información de valor. Una radiografía puede mostrar el aspecto de “apolillado” que es el resultado de una fina destrucción del hueso que se hace confluente con el tiempo. La TC es útil para determinar la integridad de la corteza del hueso, dado que esto se correlaciona con el riesgo de fracturas patológicas que pueden ocurrir en 10 a 15% de los casos. La RMN es útil para definir la relación cn otros elementos de partes blandas como planos fasciales, vasos y nervios.
Para buscar diseminación metastásica a pulmones, huesos y otras vísceras, un scan óseo coN Tc 99 o un PET 18F-FDG de tórax, abdomen y pelvis pueden ser utilizados. Una biopsia de médula ósea puede ser llevada a cabo en estos pacientes con enfermedd clínicamente localizada para detectar metástasis ocultas en médula ósea.
En este paciente no se llevó a cabo una biopsia de médula dado que el paciente ya tiene una enferemdad avanzada. Además de la extensión del tumor, y los factores genéticos predictores, la presencia de fiebre, anemia y LDH elevadason todos marcadores de mal pronóstico. (12)
Tratamiento.
Aun para el sarcoma de Ewing localizado, 80 a 90% de los pacientes tratados con terapia local sola tendrán probablemente una recidiva con metástasis sistémicas y finalmente morirán de la enfermedad. (13) Por lo tantoel sarcoma de Ewing es visto como enfermedad sistémica y el tratamiento inicial es similar para el sarcoma de Ewing metastásico. Un año de quimioterapia combinada (vincristina, doxorrubucina, ciclofosfamida, o dactinomicina) resultaron en un mejoramiento de las tasas de sobrevida de 10% a los 5 años en 1965 a casi 60% en 1990. (14) La resección quirúrgica del tumor primario y la remoción o irradiación de todos los sitios de metástasis son considerados para pacientes que tienen respuesta a la terapia sistémica. Los pacientes con enfermedad localizada tienen un 80% de tasas de cura, y los pacientes con enfermedad metastásica tienen 15 a 40% de tasa de remisión durable (40% solo para las metástasis pulmonares y 20 a 25% para metástasis en médula ósea. Dado que no hay forma de saber qué pacientes con metástasis eventualmente podrán ser curados hay que encarar el tratamiento del sarcoma de Ewing siempre con un approach curativo cada vez que sea posible.
Dado que la mayoría de los pacientes con enfermedad metastásica no son curados con un tratamiento standard, nuevas estrategias terapéuticas están siendo estudiadas. El “Intergroup Ewing's Sarcoma Study” (IESS-III) utilizó una combinación de quimioterápicos con ifosfamida y etopósido, alternando convincristina, doxorrubicina, y ciclofosfamida. (15) El estudio mostró que el paciente con efermedad metastásica no se benefició del agregado de ifosfamida y etopósido. El tratamiento intensivo con altas dosis de quimioterapia y trasplante de stem-cell ha dado resultados mixtos. El gran estudio en curso European Ewing Tumour Working Initiative of National Groups
Finalmente un estudio investigacional en sarcoma de Ewing es con insulin-like growth factor receptor (IGF-IR). El receptor para IGF-I E IGF-II, IGF-IR, es un receptor de transmembrana con actividad de tirosin kinasa que después de unirse al ligando activa la vía del fosfatidilinositol 3' kinasa, LA VÍA DE ras-mapk, las Janus kinasas y señales de transducción y activadores de transcripción (la vía de JAK-STAT), que conducen a proliferación celular y sobrevida. (17,18) En varios estudios en fase 1 que involucran anticuerpos que bloquean el IGF-IR, se han visto respuestas en pacientes con sarcoma de Ewing, inspirando a los investigadores a enfocar a esos pacientes a estudios de fase 2. (19,20,21) La próxima generación de estudios de IGF-IR involucrará probablemente la combinación de IGF-IR con quimioterapia o con otros inhibidores de la transducción de señales.
En síntesis en este paciente estaría recomendado terapia standard con 17 ciclos de quimioterapia combinada con vincristina, doxorrubicina, ciclofosfamida y dactinomicina seguidos de radioterapia del sitio primario y de enfermedad residual metastásica.
Se trató con un esquema similar pero el paciente falleció 1 año después.
Diagnóstico final:
Sarcoma de Ewing de hueso con metástasis pulmonares y a ganglios mediastinales.
Fuente: Division of Medical Oncology, Department of Medicine (E.C.), and the Departments of Radiology (S.R.D.) and Pathology (S.A.K.), Massachusetts General Hospital; and the Departments of Medicine (E.C.), Radiology (S.R.D.), and Pathology (S.A.K.), Harvard Medical School.
Conclusiones del caso.
Poco podemos agregar de este caso desgraciado y de esta agresiva enfermedad que afecta adultos jóvenes (promedio 20 años), que no se hayan dicho en este ejercicio anatomoclínico. Descripta en 1921 por James Ewing como un tumor indiferenciado que afecta las diáfisis de los huesos largos, y que a diferencia del osteosarcoma, este es un tumor radiosensible. Puede asimismo afectar partes blandas (sarcoma extraóseo). En los últimos años se ha visto que estas entidades son manifestaciones de una misma enfermedad conocidas como “familia de tumores del sarcoma de Ewing” que también incluyen al tumor de células malignas pequeñas de la pared torácica (tumor de Askin) y el sarcoma de Ewing atípico. La familia de tumores del sarcoma de Ewing pueden asentar en casi cualquier hueso o partes blandas de la economía pero los sitios más comunes son los huesos planos y los huesos largos y los pacientes casi siempre se presentan con dolor e inflamación. Aunque la enfermedad metastásica declarada se encuentra en solo el 25 por ciento de los pacientes en el momento del diagnóstico, casi todos los pacientes deben tener enfermedad metastásica subclinica ya que el 80 a 90 por ciento de los pacientes tratados exclusivamente con terapia local recaen, y por lo tanto la quimioterapia sistémica es un componente fundamental del tratamiento. Se ha avanzado mucho en el tratamiento multidisciplinario de esta enfermedad en los últimos 30 años lo cual ha resultado en un mejoramiento del pronóstico y las expectativas de vida. Y sobre todo se ha avanzado en lo que se llama cirugía conservadora es decir la no amputación del miembro cuando la localización era en dicha área lo cual era la regla. Hoy en día la expectativa de vida en pacientes con enfermedad no metastásica que reciben un moderno tratamiento multidisciplinario puede alcanzar 70 a 80 por ciento. En el caso analizado aquí la evolución fue mala pero hay que considerar que el diagnóstico se llevó a cabo en un estadio sumamente avanzado de la enfermedad.
Referenias.
1. Dominguez Malagón H, Pérez Montiel D. Mediastinal germ cell tumors. Semin Diagn Pathol 2005;22:230-240. [CrossRef][Web of Science][Medline]
2. Turc-Carel C, Aurias A, Mugneret F, et al. Chromosomes in Ewing's sarcoma. I. An evaluation of 85 cases of remarkable consistency of t(11;22)(q24;q12). Cancer Genet Cytogenet 1988;32:229-238. [CrossRef][Web of Science][Medline]
3. Zoubek A, Dockhorn-Dworniczak B, Delattre O, et al. Does expression of different EWS chimeric transcripts define clinically distinct risk groups of Ewing tumor patients? J Clin Oncol 1996;14:1245-1251. [Free Full Text]
4. Zoubek A, Pfleiderer C, Salzer-Kuntschik M, et al. Variability of EWS chimaeric transcripts in Ewing tumours: a comparison of clinical and molecular data. Br J Cancer 1994;70:908-913. [Web of Science][Medline]
5. de Alava E, Antonescu CR, Panizo A, et al. Prognostic impact of P53 status in Ewing sarcoma. Cancer 2000;89:783-792. [CrossRef][Web of Science][Medline]
6. de Alava E, Kawai A, Healey JH, et al. EWS-FLI1 fusion transcript structure is an independent determinant of prognosis in Ewing's sarcoma. J Clin Oncol 1998;16:1248-1255. [Erratum, J Clin Oncol 1998;16:2895.] [Free Full Text]
7. de Alava E, Panizo A, Antonescu CR, et al. Association of EWS-FLI1 type 1 fusion with lower proliferative rate in Ewing's sarcoma. Am J Pathol 2000;156:849-855. [Free Full Text]
8. Honoki K, Stojanovski E, McEvoy M, et al. Prognostic significance of p16 INK4a alteration for Ewing sarcoma: a meta-analysis. Cancer 2007;110:1351-1360. [CrossRef][Web of Science][Medline]
9. Wei G, Antonescu CR, de Alava E, et al. Prognostic impact of INK4A deletion in Ewing sarcoma. Cancer 2000;89:793-799. [CrossRef][Web of Science][Medline]
10. Abudu A, Mangham DC, Reynolds GM, et al. Overexpression of p53 protein in primary Ewing's sarcoma of bone: relationship to tumour stage, response and prognosis. Br J Cancer 1999;79:1185-1189. [CrossRef][Web of Science][Medline]
11. Caudill JS, Arndt CA. Diagnosis and management of bone malignancy in adolescence. Adolesc Med State Art Rev 2007;18:62-78.
12. Cotterill SJ, Ahrens S, Paulussen M, et al. Prognostic factors in Ewing's tumor of bone: analysis of 975 patients from the European Intergroup Cooperative Ewing's Sarcoma Study Group. J Clin Oncol 2000;18:3108-3114. [Free Full Text]
13. Ludwig JA. Ewing sarcoma: historical perspectives, current state-of-the-art, and opportunities for targeted therapy in the future. Curr Opin Oncol 2008;20:412-418. [Web of Science][Medline]
14. Arndt CA, Crist WM. Common musculoskeletal tumors of childhood and adolescence. N Engl J Med 1999;341:342-352. [Free Full Text]
15. Grier HE, Krailo MD, Tarbell NJ, et al. Addition of ifosfamide and etoposide to standard chemotherapy for Ewing's sarcoma and primitive neuroectodermal tumor of bone. N Engl J Med 2003;348:694-701. [Free Full Text]
16. Juergens C, Weston C, Lewis I, et al. Safety assessment of intensive induction with vincristine, ifosfamide, doxorubicin, and etoposide (VIDE) in the treatment of Ewing tumors in the EURO-E.W.I.N.G. 99 clinical trial. Pediatr Blood Cancer 2006;47:22-29. [CrossRef][Web of Science][Medline]
17. Pollak M. Insulin and insulin-like growth factor signalling in neoplasia. Nat Rev Cancer 2008;8:915-928. [Erratum, Nat Rev Cancer 2009;9:224.] [CrossRef][Web of Science][Medline]
18. Toretsky JA, Kalebic T, Blakesley V, LeRoith D, Helman LJ. The insulin-like growth factor-I receptor is required for EWS/FLI-1 transformation of fibroblasts. J Biol Chem 1997;272:30822-30827. [Free Full Text]
19. Benjamin RS, Gore L, Dias C, et al. Activity of R1507, a fully humanized monoclonal antibody IGF-1R (insulin-like growth factor receptor) antagonist, in patients with Ewing's sarcoma noted in a phase I study. Seattle: Connective Tissue Oncology Society, 2007.
20. Olmos D, Okuno S, Schuetze SM, et al. Safety, pharmacokinetics and preliminary activity of the anti-IGF-IR antibody CP-751,871 in patients with sarcoma. In: Program and abstracts of the 44th Annual Meeting of the American Society of Clinical Oncology, Chicago, May 30–June 3, 2008.
21. NCI clinical trials search results for treatment trials on soft tissue sarcoma. Bethesda, MD: National Cancer Institute, 2009. (Accessed October 23, 2009, at http://www.cancer.gov/search/ResultsClinicalTrials.aspx?protocolsearchid=5994605.)