Paciente masculino de 42 años
![]() |
| Hospital "Dr Ángel Pintos" de Azul |
MOTIVO DE INTERNACIÓN: síndrome febril intermitente de 21 días de duración.
ANTECEDENTES DE ENFERMEDAD ACTUAL:
Comienza con fiebre hace 21 días que dura según el paciente dos días , con descenso espontáneo y nuevo pico febril a los 5 días. Presento los días siguientes escalofríos con registros febriles intermitentes, hasta las 72 horas previas al ingreso hospitalario cuando se instala fiebre persistente. Se decide su internación.
ANTECEDENTES PATOLÓGICOS: litiasis renal, cirugía pielocalicial. (2009)
EXAMEN FÍSICO
Al ingreso lucido, con T de 38 ºC, hipotenso 80/60, FC 100 latidos minuto,
Examen respiratorio :buena mecánica respiratoria, sin ruidos agregados
Examen cardiovascular R1 R2 positivo en 4 focos hipofoneticos, soplo sistólico de intensidad 1/6, sin signos de Insuficiencia cardiaca.
Examen abdominal: abdomen blando, depresible, indoloro.
Sin adenopatías periféricas.
Sin foco neurológico.
Fauces: muy mal estado dentario, piezas faltantes.
Piel : presenta lesiones compatibles con psoriasis en ambas rodillas, y codos.
![]() |
| Placa de psoriasis en remisión. |
LABORATORIO DE INGRESO:
Blancos 9100, Hto 41 Hb 14.2 Urea 51Creatinina 1.10 CPK 63 Na 142, K 4.67, cloro 103 Hepatograma normal VSG 30 Sedimento urinario: no patológico
RX DE TORAX. s/p
UROCULTIVOS Y HEMOCULTIVOS SE SOLICITAN
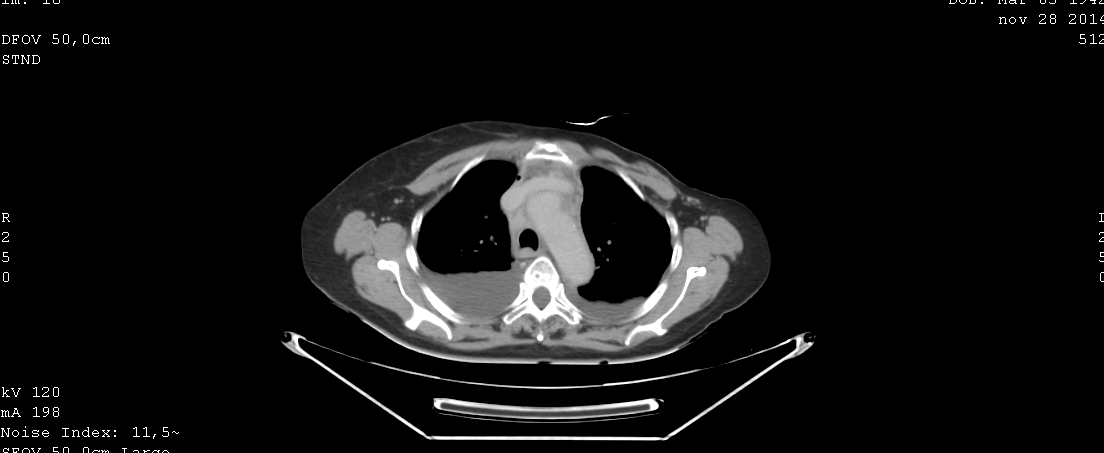
ECOGRAFIA ABDOMINAL: esplenomegalia de 16 cm.
TAC DE ABDOMEN Y PELVIS: lito en silueta renal izquierda. Esplenomegalia.
Se interpreta el cuadro como síndrome febril en estudio
EVOLUCIÓN
Se reciben resultados de hemocultivos: 2/2 positivos para cocos gram positivos en cadenas.
Por diagnostico presuntivo de endocarditis infecciosa de valvula nativa se inicia tratamiento empirico con ampicilina 4 gr cada 6 hs ev.
Mientras se espera el resultado del antibiograma se agrega gentamicina al tratamiento.
Ecocardiograma transtoracico: no evidencia signos de endocarditis.
Se solicita ecocardiograma transtorácico (ETE)
Se realiza fondo de ojo: no se observan signos focales, papilas y vasculatura normales.
Se recibe resultado de antibiograma: estreptococcos grupo anginosus/ constellatum
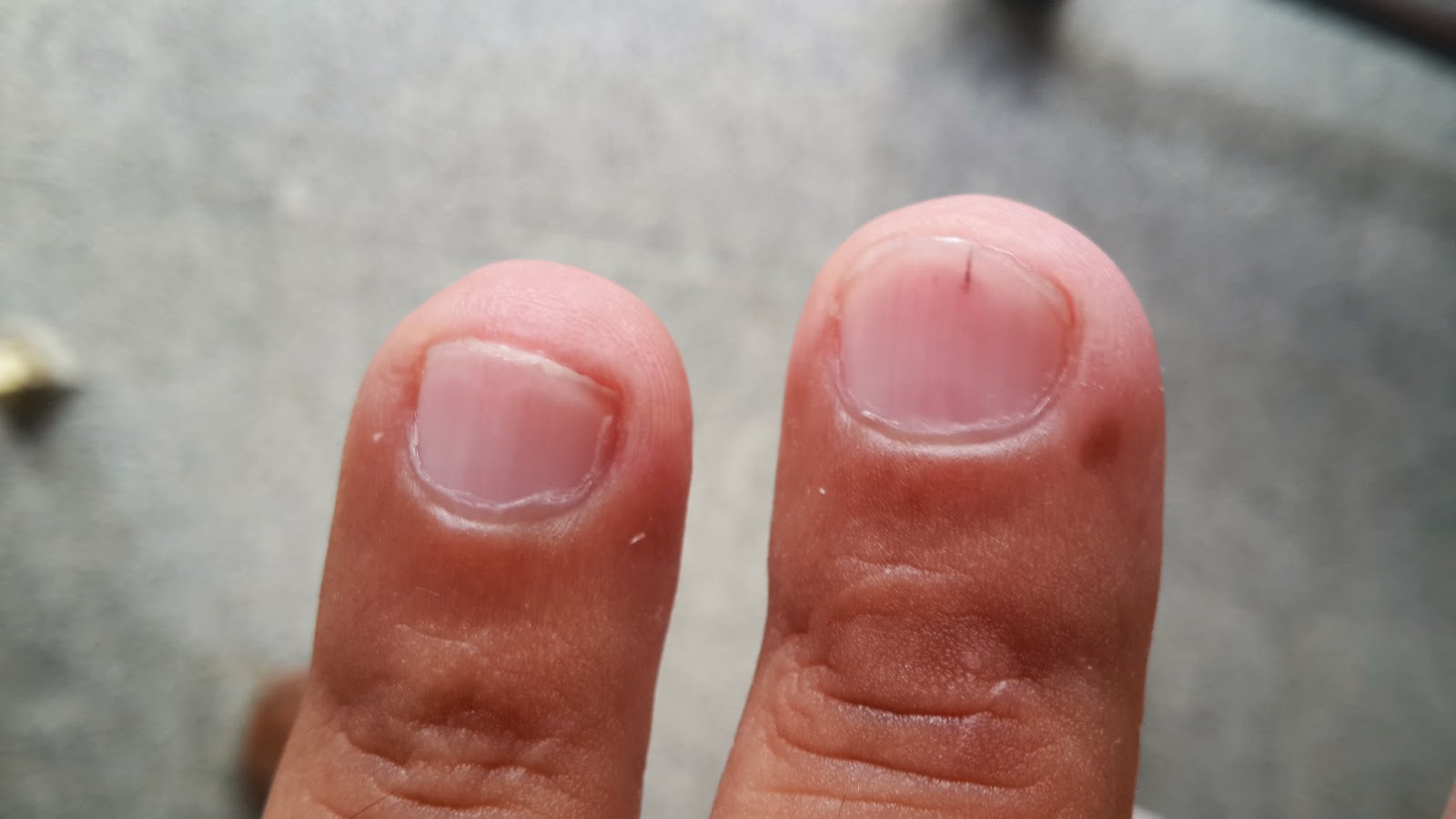
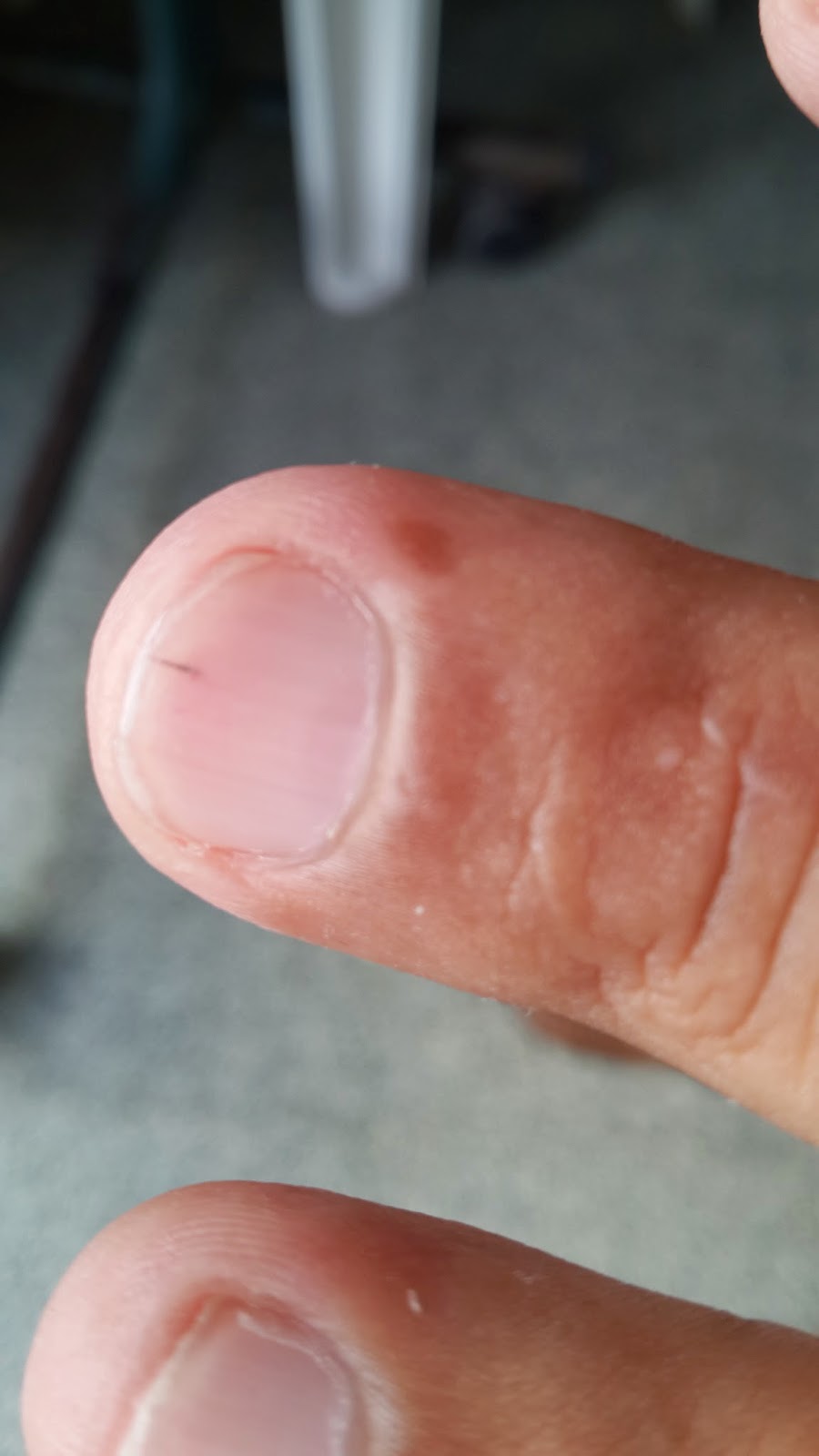
Aparecen lesiones en las uñas compatibles con hemorragias en astilla
![]() |
| Hemorragias en astilla ("splinters") |
![]() |
| Hemorragias en astilla ("splinters") |
![]() |
| Hemorragias en astilla ("splinters") |
Se realiza CIM a penicilina : 0.10 mcg/ml (germen sensible).
Intercurre con dolor intenso en pantorrilla izquierda, por lo cual se solicita ecodoppler venoso y arterial y ecografia de partes blandas. El Doppler venoso no se pudo realizar y la ecografía de partes blandas fue negativa.
Se realiza ETE:
Informa: “valvula mitral: leve prolapso de valva anterior con insuficiencia leve.
valvula tricuspide: aspecto normal. flujo tricuspideo anterogrado normal con insuficiencia leve.
valvula aortica: tricuspides con vegetacion adherida a la valva posterior no coronaria de 1 cm por 1 cm. se ve el cayado aortico, y aorta descendente, sin placas ni fuentes emboligenas.
con insuficiencia aortica de leve a moderada.
arteria pulmonar y la valvula son normales.
ventriculo izquierdo normal, funcion sistolica normal.
conclusion: vegetacion aortica, insuficiencia aortica de leve a moderada”.
CONCLUSIÓN
Diagnóstico final: endocarditis de válvulaaórtica por estreptococcos grupo anginosus.
El paciente continua con tto atb con ampicilina y gentamicina por 3 semanas con buena evolución.
Se indica alta hospitalaria y se le entrega orden para ete a realizarse en forma ambulatoria.
ENDOCARDITIS INFECCIOSA
DEFINICION Y EPIDEMIOLOGIA
La lesión prototípica de la EI es la vegetación o verruga, que consiste en una masa de plaquetas, fibrina, pequeñas colonias de microorganismos y escasas células inflamatorias.
La infección afecta con mayor frecuencia las válvulas cardiacas.
En los países desarrollados la incidencia de EI fluctúa entre 2.6 y 7 casos por 100.000 habitantes por año.
Aproximadamente 10.000 a 15.000 casos nuevos de EI son diagnosticados en EEUU por año
En un estudio observacional en Francia la incidencia anual fue de 33.8 casos por millón. La incidencia fue mayor en hombres entre los 75 a 79 años, y la mayoría no tenia enfermedad cardiaca previa.
La EI asociada al cuidado de la salud represento el 27% de los casos.
FACTORES DE RIESGO
Edad >60 años: adultos mayores son mas propensos a desarrollar enfermedad valvular degenerativa, y a requerir reemplazo valvular.
Sexo masculino
Usuarios de drogas EV
Mala dentición o infección dental
CONDICIONES COMÓRBIDAS:
Enfermedad estructural cardiaca, profilaxis antimicrobiana, enfermedad valvular, enfermedad de válvula mitral y de válvula aortica, enfermedad cardiaca congénita, estenosis pulmonar, válvula cardiaca protésica, historia previa de EI, presencia de dispositivo intravascular, endocarditis nosocomial, hemodiálisis crónica, infección por HIV
MICROBIOLOGIA
StreptococcoS y Staphilococcus son la mayoría de los casos.
Entre 2781 pacientes de una cohorte grande la distribución de los patógenos fue:
S. aureus: 31%
E. grupo viridans: 17%
Enterococo: 11 %
S. coagulasa negativo: 11 %
E. bovis: 7 %
Otros estreptococos: 5 %
Bacterias Gram negativa no HACEK: 2%
Hongos: 2%
HACEK: 2 %
MANIFESTACIONES CLÍNICAS
La EI generalmente se presenta en forma aguda.
Una cuidadosa historia clínica debe realizarse, incluidos procedimientos quirúrgicos y médicos.
Lesiones cardiacas preexistentes y posibles focos infecciosos o bacteriemias recientes o usuarios de drogas intravenosas.
EXAMEN FÍSICO
Examen cardiaco cuidadoso.
Lesiones no específicas como: petequias, lesiones en la conjuntiva se presentan como hemorragias que se ven con la eversión de los parpados, las hemorragias en astilla son también inespecíficas.
Lesiones mas especificas de EI: lesiones de Janeway, nódulos de Osler, y manchas de Roth. Estas ocurren en un entorno prolongado de bacteriemia.
Pueden tener afectación de otros órganos debido a infección metastasica, eventos embolicos, reacción inmune sistémica. (glomerulonefritis).
En endocarditis de cavidades derechas la embolia pulmonar séptica puede ser vista.
DIAGNÓSTICO
Se basa en una combinación de factores: historia clínica y examen físico cuidadoso, cultivos de sangre, ecocardiograma , ECG y Rx de tórax.
CRITERIOS DE DUKE
El diagnostico de EI es generalmente directo en el entorno de hemocultivos positivos para un patógeno que puede causar endocarditis, junto con evidencia de afectación del endocardio.
Sin embargo esto es dificultoso, de distinguir entre EI y una fuente alternativa de infección en un paciente con bacteriemia con enfermedad cardiaca subyacente.
Algunos pacientes con EI no tienen cultivos de sangre positivos, y hasta un 25% de los pacientes no tienen lesión cardiaca identificable en la presentación inicial. Las características atípicas retrasan el diagnostico.
CRITERIOS MAYORES
1. HEMOCULTIVO POSITIVO
_microorganismo típico de la EI obtenido en dos HC diferentes. Estreptococo viridans, S. gallalyticus, mo del grupo HACEK, S. aureus, o Enterococos adquiridos en la comunidad en ausencia de un foco primario o
_Hemocultivo positivo persistente, definido como la recuperación de un microorganismo compatible con una EI a partir de:
_HC extraidos con una separación > 12 horas; o
_3 o mas 4 HC diferentes, con una separación de por lo menos una hora entre la extracción del primero y el ultimo
_UN SOLO RESULTADO POSITIVO DE CULTIVO DE COXIELLA BURNETTI O UN TITULO DE AC IgG de fase I > 1:800.
2. SIGNOS DE AFECCION ENDOCARDICA
_ECOCARDIOGRAMA POSITIVO: tumoración intracardiaca oscilante en una válvula, en las estructuras de apoyo, o en la vía de chorros de insuficiencia mitral o en material implantado, o absceso o nueva dehiscencia parcial de una prótesis valvular o
Nueva insuficiencia valvular.
CRITERIOS MENORES
1. PREDISPOSICION: cardiopatía predisponente o consumo de drogas por via EV.
2. FIEBRE > DE 38 º C.
3. FENOMENOS VASCULARES: embolia arterial relevante, infartos pulmonares sépticos, aneurisma micotico, hemorragia intracraneal, hemorragias conjuntivales, lesiones de Janeway.
4. FENOMENOS INMUNITARIOS: glomerulonefritis, nódulos de Osler, manchas de Roth, Factor reumatoideo.
5. DATOS MICROBIOLOGICOS: HC pero que no cumple con los criterios mayores previamente indicados o signos serológicos de infección activa por un microorganismo compatible con una EI.
ENDOCARDITIS DEFINITIVA: 2 mayores; 1 mayor y 3 menores; o 5 menores.
Se recomienda la ETE para evaluar EI de válvula protésica o EI complicada.
Se excluyen los HC aislados para S. coagulasa positivos y difteroides que son contaminantes, y los gram negativos que no causan con frecuencia EI.
ESTUDIOS DE LABORATORIO
Cultivos de sangre: al menos 3 muestras de cultivos de sangre deben obtenerse durante un periodo de 1 hora antes del inicio de la terapia antimicrobiana empírica.
Cada conjunto de cultivos deben obtenerse de sitios de venopuntura separados.
HEMOCULTIVOS
Microorganismos típicos de EI: S. aureus, Streptococcus viridans y S. bovis, enterococo, grupo HACEK.
El riesgo de EI en pacientes con bacteriemia por S. aureus, es particularmente alto. Como resultado todos los pacientes con recuperación de S. aureus de los HC deben evaluarse para EI.
La probabilidad de EI depende de la especie de bacteria:
_la bacteriemia por Streptococcus sanguis es mas indicativo de EI que la bacteriemia por S. milleri (o anginosus )
_la bacteriemia debido a grupo A o C de estreptococo es raramente asociada con EI; mientras que el grupo G se asocia mas frecuentemente.
_la bacteriemia por Enterococo faecalis se asocia mas con EI que otras especies de enterococos.
ENDOCARDITIS CON CULTIVO NEGATIVO:
Debe considerarse en pacientes con cultivos negativos y persistencia de la fiebre con uno o mas signos clínicos consistentes con EI (por ej : ACV o otra manifestación de embolia. También ptes con vegetación en el ecocardiograma y no diagnostico claro microbiológico
LABORATORIO /ESTUDIOS CARDIACOS
La utilidad de otros test de laboratorio en el diagnostico es limitada.
Aumento de VSG, anemia normocitica normocromica, la mayoría de los ptes presentan leucocitosis, y algunos tienen trombocitopenia
En algunos ptes: hiperglobulinemia, crioglobulinemia, complejos inmunes circulantes, hipocomplementemia, títulos elevados de factor reumatoideo.
Muchos tienen análisis de orina anormal, como manifestación de hematuria, proteinuria y/o piuria
ECOCARDIOGRAMA: debe realizarse en ptes con sospecha moderada a alta de EI.
Si tienen sospecha baja de EI, el rendimiento diagnostico de EI con ETT Y ETE es bajo y nunca debe realizarse.
Permite detectar y caracterizar las vegetaciones de las válvulas u otros sitios, evaluar la disfunción valvular, la severidad hemodinámica y anormalidades asociadas como abscesos.
El ETT: es la primera prueba diagnostica para los ptes con sospecha de EI. Tiene baja sensibilidad ( 29 al 63%) aunque la especificidad es del 100%.
INDICACIONES DE ETE:
Alta sospecha de EI: persistencia de HC positivos y múltiples criterios menores para EI.
Bacteriemia debida a un organismo conocido como S. aureus o Stretococcus viridans.
Un estudio de ETT técnicamente malo.
INDICACIONES DE ETE (SIN ETT PREVIO)
_presencia de válvula protésica (mitral o aortica)
_anormalidad valvular previa (incluye previa endocarditis)
_ventana transtoracica limitada: por obesidad, pared torácica deformada, o ventilación mecánica.
ECG: como parte del estudio inicial , la presencia de bloqueo de rama o retraso en la conducción puede dar una pista de extensión de la infección al anillo valvular o al septum adyacente. La presencia de hallazgos consistentes con isquemia o infarto sugieren la presencia de émbolos en la circulación coronaria.
Rx de tórax: puede demostrar la presencia de embolia pulmonar séptica.
RM: ptes con dolor de espalda deben evaluarse para osteomielitis vertebral y discitis con RM
TAC: ptes con dolor abdominal o del ángulo costo vertebral : para evaluar la presencia de infarto esplénico, infarto renal, absceso del psoas.
DIAGNOSTICOS DIFERENCIALES
Infección de piel y tejidos blandos.
Infección de dispositivo cardiaco
Infección de articulación protésica
Infección de catéter intravascular
Osteomielitis
Meningitis
Neumonía
COMPLICACIONES
Incluye complicaciones cardiacas, neurológicas, renales, musculoesqueleticas, y las relacionadas con la infección sistémica.
La infección por S. aureus se asocio con mas complicaciones que otros patógenos.
Complicaciones cardiacas: son las mas comunes, ocurren en hasta ¼ de los pacientes.
Falla cardiaca:
La implicación de la válvula aortica causa mas IC que válvula mitral.
El germen involucrado.
Es la causa mas común de cirugía cardiaca.
Se produce por insuficiencia valvular.
Absceso perivalvular:
La válvula aortica es mas susceptible al mismo.
Se asocia con riesgo de embolizacion y muerte.
Pericarditis.
Fistula intracardiaca.
INFECCION METASTASICA : incluye la embolizacion, el absceso metastasico, y el aneurisma micotico.
EMBOLIZACION SEPTICA: la sistémica ocurre mas frecuentemente en EI del lado izquierdo; y la pulmonar con EI del lado derecho.
Causa:
ACV, parálisis, ceguera, isquemia en las extremidades, infarto renal o esplénico, embolia de pulmón, infarto agudo de miocardio.
Factores de riesgo : vegetación del lado izquierdo, de gran tamaño, microbiología, presencia de Ac antifosfolipido, edad, DBT, FA.
ABSCESO MTS: como secuela de embolizacion (en cerebro, bazo , riñón, tejidos blandos)
ANEURISMA MICOTICO: en los puntos de bifurcación de los vasos.
COMPLICACIONES NEUROLOGICAS:
ACV, absceso cerebral o cerebritis, meningitis purulenta o aséptica
Encefalopatía aguda
Meningoencefalitis
Hemorragia cerebral
Convulsiones
COMPLICACIONES RENALES: infarto renal o absceso seguido de embolizacion séptica, Glomerulonefritis, nefritis intersticial inducida por drogas, falla renal aguda (creatinina > 2 mg/dl) en hasta 1/3 de los pacientes
COMPLICACIONES MUSCULOESQUELETICAS:
Osteomielitis vertebral, y artritis séptica.
COMPLICACIONES RELACIONADAS CON LA TERAPIA:
AMINOGLUCOSIDOS: nefro y ototoxicos.
FIEBRE POR DROGAS
ALERGIA
HEMORRAGIA POR ANTICOAGULANTES
TERAPIA ANTIMICROBIANA
Los agentes bactericidas son necesarios para el tratamiento efectivo de la endocarditis.
La determinación de la concentración inhibitoria mínima debe obtenerse de rutina.
Terapia empírica: debe dirigirse a los microorganismos aislados de los HC, los cultivos son positivos en mas del 90% de los ptes con EI.
Para ptes con sospecha de EI sin síntomas agudos, la terapia empírica puede esperar hasta los resultados de los HC
Para la enfermedad aguda en ptes con signos y síntomas fuertemente sugestivos de EI, la terapia empírica es necesaria , solo después de al menos dos (mejor 3) muestras de HC, y espaciadas con un tiempo de 30 a 60 minutos.
La terapia empírica debe cubrir Estafilococo (meticilino sensible y resistente) estreptococo, y enterococo.
La vancomicina (15-20 mg/kg/dosis cada 8 a 12 hs )es una elección apropiada para la terapia inicial en la mayoría de los pacientes.
Respuesta clínica: la mayoría de los ptes comienzan a estar afebriles del 3 al 5 dia del inicio atb.
Ptes con Endocarditis por S. aureus responden mas lento, afebriles al dia 5 a 7. Ptes con EI derecha y embolia pulmonar séptica permanecen febriles por mucho tiempo.
A las 48-72 horas de inicio del tto se repiten los HC.
DURACIÓN DE LA TERAPIA: depende del patógeno y del sitio de la infección valvular. En general 6 semanas de tto es apropiado para patógenos virulentos o relativamente resistentes, con complicaciones cardiacas o extracardiacas, y en el contexto de infección prolongada antes del diagnostico.
ESTREPTOCO VIRIDANS Y ESTREPTOCOCO BOVIS: varias especies de estreptoco que conforman el grupo viridans y estreptococo bovis representan alrededor del 40 al 60% de la EI de valvula nativa en la practica comunitaria.
Los miembros del grupo viridans incluyen: S. mitis, S.mutans, S. oralis, s. sanguinis, S. sobrinus, y el grupo S. milleri (S. anginosus, S. constellatus, y S. intermedius)
La mayoría del S. grupo viridans son altamente sensible a la peniclina definida como una CIM <0 .12="" mcg="" ml.="" o:p="">0>
Cepas ocasionales pueden tener susceptibilidad intermedia CIM > 0.12 y < de 0.5 mcg/ml; y raramente cepas resistentes con una CIM > 0.5 mcg/ml.
Para EI por S. grupo viridans y S. bovis tenemos 4 diferentes regímenes de tto
PARA CIM de < .12 mcg/ml, la AHA (American Heart Association), la BSAC, (British society for antimicrobial chemoteraphy), y la ESC (European society of cardiology) recomiendan:
PENICILINA G ACUOSA CRISTALINA 12 a 24 Millones de U/dia (en forma continua o en 4 a 6 dosis igualmente divididas) por 4 semanas, en ptes con Streptococo altamente sensible a penicilina.
O ceftriaxona 2 gr/dia por 4 semanas
Pacientes seleccionados con EI de válvula nativa por cepas sensible a la Penicilina que no tienen evidencia de complicaciones intracardiacas o extracardiacas o lesiones oticas ni renales pueden tratarse con cursos cortos de terapia combinada:
AHA: gentamicina mas Peni G o ceftriaxona por 2 semanas.
ESC: monoterapia con Peni G por dos semanas.
Los ptes con alergia a la Penicilina pueden tratarse con ceftriaxona , si la alergia consiste en rash sin otros signos de hipersensibilidad de tipo inmediato.
Ptes con historia de hipersensibilidad de tipo inmediato: vancomicina por 4 semanas ; o desensibilización a la penicilina y tratados con un régimen standard
Se aconseja la desensibilización a la Penicilina en lugar de la sustitución por vancomicina.
TRATAMIENTO DE EI POR S. VIRIDANS CON SUSCEPTIBILIDAD INTERMEDIA (MIC > 0.12 Y < 0.5).
La AHA guidelines recomienda Peni G 24 Mill U/dia o ceftriaxona , por 4 semanas. Mas gentamicina las primeras dos semanas
La guía BSAC 2012 recomienda para EI por streptococo con CIM de > 0.12 a < 0.5 , : bencilpenicilina por 4 a 6 semanas mas un AMG las dos primeras semanas de tto.
Con MIC > de 0.4 mcg/ml tanto la ESC y la BSAC recomiendan vancomicina
OTRAS ESPECIES DE ESTREPTOCOCOS: por ejemplo grupo A, B, C, G, a S. pneumoniae, son ocasionalmente causa de endocarditis. La mayoría son altamente sensibles a la Penicilina.
STREPTOCOCCUS ANGINOSUS (STREPTOCOCCUS MILLERI)
INTRODUCCIÓN
El grupo S anginosus (también conocido como el S grupo milleri ) es un subgrupo de estreptococos viridans que consta de tres especies de estreptococos distintas: S. anginosus, S. intermedius, y S. constellatus; A su vez S. constellatus tiene dos subespecies, S. constellatus y S. subsp constellatus pharyngis (1-6). Estos estreptococos viridans no hemolíticos fueron descritos por primera vez por Guthof en 1956 después de haber sido aislado de abscesos dentales. Llamó a estos organismos "Streptococcus milleri" en honor del microbiólogo WD Miller (1,7).
Los organismos fueron posteriormente reconocidos como flora normal de la cavidad oral humana y el tracto gastrointestinal con la capacidad de causar abscesos e infecciones sistémicas (8-12). La característica especial y única, a diferencia de otros estreptococos patógenos, como S. pyogenes (estreptococos del grupo A) y S. agalactiae (estreptococo del grupo B), es su capacidad para causar abscesos (13). A diferencia de los miembros menos virulentos de los estreptococos viridans, los miembros del S grupo anginosus deben ser considerados verdaderos patógenos cuando son aislados(14-16).
MICROBIOLOGÍA
Los miembros de S grupo anginosus son cocos grampositivos catalasa-negativos (al igual que otros miembros del género Streptococcus). Son, anaerobios facultativos no móviles que muestran patrones de hemólisis variables (alfa, beta, o gamma) en agar sangre de carnero (17). Las colonias son típicamente pequeñas (tamaño de la colonia de menos de 0,5 mm) (18). Muchas cepas demuestran un mayor crecimiento en presencia de CO2, mientras que algunas cepas pueden requerir condiciones anaeróbicas.
Casi el 40 por ciento de S. constellatus y el 12 por ciento de S. anginosus son beta-hemolíticos, mientras que el 93 por ciento de las cepas de S. intermedius no son beta-hemolíticos [4].
Los miembros del S grupo anginosus pueden ser diferenciados de otros estreptococos utilizando una combinación de tres pruebas rápidas [4,17]:
● prueba de Voges-Proskaur para la producción acetoína
● La hidrólisis con arginina.
● No fermentan sorbitol
Un olor a caramelo olor debido a diacetilo es útil para identificar el grupo S. anginosus cuando está presente, pero no es una prueba de detección suficientemente sensibles [19].
Normalmente hay poca necesidad clínica de distinguir entre los tres miembros de S grupo anginosus (20). Si es necesario, S. anginosus se puede diferenciar por la falta de hialuronidasa. S. intermedius puede diferenciarse por la beta-galactosidasa (ONPG) y las reacciones de beta-N-acetil-glucosaminidasa. S. constellatus es más probable que sea beta-hemolíticos y para reaccionar con el grupo serológico de anticuerpos Lancefield F que las otras dos especies.
Kits de diagnóstico rápido y sistemas automatizados están disponibles para la identificación del grupo viridans a nivel de especie y grupo (21-23). Ensayos de amplificación de ácidos nucleicos se han desarrollado pero no están aún en uso rutinario (22,24)
PATOGÉNESIS
Los miembros de S grupo anginosus son conocidos por su patogenicidad y la tendencia a la formación de abscesos. Los factores de virulencia precisos responsables de estos aspectos clínicos no se conocen bien. Además, hay diferencias en los factores de virulencia intrínsecas entre las especies que componen el grupo. Factores de adherencias a las superficies celulares son expresadas por todos los miembros del grupo y permiten la unión a fibronectina; algunas cepas también son capaces de unirse a los complejos plaquetas/fibrina [28,29]. Una cápsula de polisacárido asociado con la agrupación Lancefield parece ser un factor de virulencia como se ha demostrado para inhibir la fagocitosis de S. constellatus en un modelo murino de infección pulmonar [30].
S. anginosus a menudo se presenta como parte de una infección polimicrobiana en pacientes con infecciones orales, de cabeza y cuello e infecciones abdominales. Los compañeros de los agentes patógenos en tales infecciones pueden incluir otras bacterias como Eikenella corrodens y Fusobacterium nucleatum.
Los miembros de S grupo anginosus producen exotoxinas pirogénicas. S. intermedius produce únicamente intermedilysina una toxina citolítica específica para las células humanas que parece ser un factor de virulencia para el hígado y otros abscesos profundos [34]. Los miembros de S grupo anginosus también producen enzimas hidrolíticas tales como hialuronidasa que pueden desempeñar un papel en la propagación de organismos a través de los tejidos y ayudar en la licuefacción de pus [35].
Interacción entre el grupo de S. anginosus y granulocitos polimorfonucleares puede desempeñar un papel en la formación de abscesos [30,36]. Los miembros de S grupo anginosus son estimuladores pobres de la quimiotaxis. Además, estos organismos parecen capaces de sobrevivir a la fagocitosis.
ENFOQUE CLÍNICO
El S grupo anginosus reside como parte de la flora normal de la cavidad oral y el tracto gastrointestinal en adultos y niños. Estos organismos pueden invadir la circulación, incluso sin un sitio clínicamente evidente de trauma o infección [37,38]. Las infecciones pueden ser polimicrobianas, incluyendo anaerobios y miembros de la familia Enterobacteriaceae [37,39].
Las infecciones que producen van desde infecciones orales menores tales como faringitis o absceso dental a infección invasiva potencialmente mortal con bacteriemia y formación de abscesos metastásicos que pueden comprometer pulmones, cerebro, hígado, riñones o partes blandas. La infección por miembros del grupo anginosus S. se asocia tan frecuentemente con abscesos [37,38] que si no logra visualizarse un absceso, el aislamiento de este organismo debería generar una mayor evaluación radiográfica en la búsqueda de abscesos tanto en adultos como en niños.
INFECCIONES ORALES Y ENDODONCIA
Los miembros de S grupo anginosus se han aislado de caries dentales y la enfermedad periodontal [40,41]. La presencia de estos organismos en la cavidad oral predispone a infecciones endodónticas y maxilofaciales, así como abscesos periamigdalinos [42], que pueden conducir a infecciones con metástasis sépticas a distancia [43,44]. S. anginosus es la especie predominante de S grupo anginosus asociado con abscesos dentales. S. subsp constellatus tiene predilección por la garganta humana dando faringitis [3].
En los niños, el S grupo anginosus se han recuperado de cultivos de garganta con frecuencia cada vez mayor [45], y los estreptococos del grupo C beta-hemolítico con faringitis exudativa se ha descrito en los estudiantes universitarios [46,47]. Por otra parte, los aislamientos de S. grupo anginosus betahemolíticos se han identificado erróneamente como S. pyogenes en cultivos de garganta pediátricos [48]. De hecho, S. subespecia constellatus faríngeo se ha propuesto para las cepas de S. grupo anginosus que son genéticamente y fenotípicamente distintas y presentan una predilección por la garganta humana y se han aislado a partir de casos clínicos de faringitis [3]. Además, dos cepas adicionales de S grupo anginosus también aisladas de pacientes con faringitis se han propuesto como nuevas subespecies: S. subespecies anginosus whileyi y S. constellatus subespecies viborgensis [49].
Infecciones orales y endodoncia menores pueden responder a la extracción de un diente infectado y / o drenaje de abscesos, junto con el tratamiento antimicrobiano oral. Infecciones orales y maxilofaciales profundas requieren hospitalización para el tratamiento antimicrobiano intravenoso y desbridamiento quirúrgico. Estos temas se discuten en detalle por separado.
Siempre debe obtenerse hemocultivos; la bacteriemia con miembros del S grupo anginosus induce una evaluación para infección metastásica incluyendo absceso cerebral en adultos y niños. [50-54].
INFECCIONES DE CABEZA Y CUELLO
Infecciones orales y endodoncia causadas por miembros del S grupo anginosus puede extenderse a los espacios exteriores de la cabeza y el cuello a través de extensión local [55-58]. Las complicaciones incluyen la obstrucción de la vía aérea, la tromboflebitis séptica de la vena yugular, el absceso de la vía aérea superior con aspiración o asfixia, absceso pulmonar, mediastinitis, pericarditis y shock séptico [59]. Estas infecciones también pueden complicarse con infección metastásica incluyendo la participación del sistema nervioso central [54,60-64].
Los miembros del S grupo anginosus causan infecciones supurativas de cabeza y cuello [57]. Estas infecciones de cabeza y cuello incluyen abscesos periamigdalino [42], rinosinusitis con complicaciones intracraneales [65,66], celulitis orbitaria [67-69], tumor hinchado de Pott [70-72], absceso cerebral [27,54], y trombosis supurada de la vena yugular (síndrome de Lemierre) [73,74]. Estas entidades pueden implicar la coinfección con otros microorganismos, incluyendo anaerobios como Fusobacterium necrophorum [75,76]. Los abscesos cerebrales en los niños son relativamente raros, pero se asocian con una morbilidad y mortalidad significativas; los microorganismos más frecuentes son el grupo anginosus S. [27,54].
El tratamiento inicial de las infecciones de cabeza y cuello debe incluir la obtención de cultivos de sangre y el inicio de la terapia antimicrobiana intravenosa inmediata que incluya la cobertura para el S grupo anginosus así como anaerobios [64]. Deben llevarse a cabo imágenes para evaluar la presencia de supuración que requiera drenaje quirúrgico.
INFECCIONES DEL SISTEMA NERVIOSO CENTRAL
Los miembros del S grupo anginosus están bien reconocidos como causantes de abscesos de sistema nervioso central que pueden involucrar cerebro, y los espacios epidurales y subdurales [27,54,63,77-82]. También se han descrito otras infecciones del SNC, tales como meningitis y trombosis del seno cavernoso o trombosis del seno lateral [27,60-62,79,82,83]. La infección puede desarrollarse después de una bacteriemia por un foco oral, dentario, o gastrointestinal o de un absceso en otro sitio. Debe llevarse a cabo la evaluación de endocarditis como fuente potencial de émbolos sépticos.
Infecciones del SNC debido a los miembros del grupo anginosus S. son potencialmente mortales. Imágenes de tomografía computarizada o resonancia magnética (con contraste) se deben realizar para evaluar colecciones que puedan requieren drenaje. Una pronta intervención quirúrgica para drenaje del absceso y el inicio oportuno de la terapia antimicrobiana apropiada son esenciales [84,85].
Los abscesos cerebrales causados por los miembros del S grupo anginosus pueden ser manejados con una cefalosporina de tercera generación como cefotaxima o ceftriaxona; metronidazol debe añadirse para el tratamiento de la infección por anaerobios concomitante [64,87].
La terapia con antibióticos por vía intravenosa se debe continuar durante cuatro a seis semanas [64,87]. Seguimiento con tomografía computarizada en intervalos mensuales está indicada durante al menos tres meses para la evaluación de la respuesta terapéutica [84].
INFECCIONES ABDOMINALES
Los miembros del S grupo anginosus son parte de la flora normal del tracto gastrointestinal en adultos y niños; Como tales, son capaces de causar una variedad de infecciones abdominales. Estos incluyen absceso hepático, colangitis, peritonitis, apendicitis, absceso subfrénico, absceso pélvico, infecciones de heridas e infecciones abdominales postoperatorias después de un traumatismo o cirugía visceral [88-94]. En los niños, la asociación de S grupo anginosus con apendicitis aguda y sus complicaciones tras apendicectomía ha sido bien descrita [93,95-97]. El papel del S grupo anginosus en abscesos intraabdominales no es causal; más bien, la presencia de S. anginosus parece resultar en la formación de abscesos después de que la inflamación ya ha comenzado. La presencia de otros microorganismos tales como Escherichia coli y Bacteroides fragilis es común [96,97] y puede proporcionar un efecto sinérgico.
Hemocultivos positivos para los miembros del S grupo anginosus deberían llevar a la consideración de infección oculta abdominal, abscesos metastásicos, y endocarditis infecciosa [37,53].
En general, el tratamiento de las infecciones abdominales causados por los miembros del S grupo anginosus requiere drenaje del absceso y terapia antimicrobiana [98]. Imágenes con tomografía computarizada se debe realizar para evaluar la presencia de colecciones que requieran drenaje.
La terapia antimicrobiana debe constar de una cefalosporina de tercera generación como cefotaxima o ceftriaxona; metronidazol debe añadirse para el tratamiento de la infección por anaerobios concomitante. Alternativamente, la monoterapia con un inhibidor de beta-lactámicos / beta-lactamasa o un carbapenem son también opciones razonables para el tratamiento antimicrobiano. La duración del tratamiento depende de la respuesta clínica; una a dos semanas es generalmente adecuado. Dos semanas de terapia deben administrarse en el contexto de la bacteriemia.
INFECCIONES TORÁCICAS
Los miembros del S grupo anginosus S son parte de la flora normal de la orofaringe; como tales, pueden ser aspiradas y pueden causar una variedad de infecciones torácicas [4-6,99-102]. Estos incluyen neumonía, absceso pulmonar, empiema y mediastinitis [102-104]. La mediastinitis pued ocurrir ya sea como una infección primaria o secundaria a la disección de una infección del cuello hacia el mediastino. Cada vez que hubiesen hemocultivos positivos deberían llevar a evaluación de abscesos metastásicos.
La colonización de las vías respiratorias superiores por S. grupo anginosus puede dar lugar a infecciones pulmonares en niños similares a los reportados en adultos. Estas infecciones a menudo son difíciles de tratar y pueden requerir procedimientos de intervención si el espacio pleural está comprometido. El S grupo anginosus también se han aislado en los cultivos de esputo de pacientes con enfermedad pulmonar crónica tal como enfermedad pulmonar obstructiva crónica, bronquiectasias, y fibrosis quística [105]. Los pacientes con fibrosis quística se han demostrado para albergar S grupo anginosus [106-108].
Las infecciones torácicas tienen morbilidad y mortalidad [37,100-102] significativas. Los factores de riesgo son el sexo masculino, el alcoholismo, el cáncer y la fibrosis quística [100-102,112].
En general, el tratamiento de las infecciones torácicas causadas por los miembros del grupo S. anginosus requiere drenaje del absceso y terapia antimicrobiana [37100101113]. Drenaje torácico percutáneo o drenaje quirúrgico del absceso pulmonar pueden ser requeridos [114]. La terapia antimicrobiana debe constar de una cefalosporina de tercera generación como cefotaxima o ceftriaxona. Alternativamente, la monoterapia con un beta-lactámicos / inhibidor de beta-lactamasa o un carbapenem son también opciones razonables para el tratamiento antimicrobiano. La duración del tratamiento depende de la respuesta clínica; cuatro semanas de tratamiento antibiótico por vía intravenosa es generalmente adecuado.
ENDOCARDITIS
Los miembros del S grupo anginosus son capaces de causar endocarditis, por lo general en el marco de una válvula cardiaca anormal [115,116]. Entre los aislamientos de estreptococos de pacientes con endocarditis, el grupo S. anginosus representa el 3 al 15 por ciento de los casos [4].
Cuándo se produce la endocarditis, es más común en pacientes con válvulas dañadas o prótesis cardiacas que en los pacientes con válvulas nativas normales.
Las complicaciones de la endocarditis pueden incluir absceso perianular, absceso de miocardio y / o infección metastásica [37,50,117]. En una revisión de 29 pacientes con EI causada por S del grupo anginosus, la cirugía cardiaca fue necesaria en el 62 por ciento de los casos; los predictores incluyen disfunción valvular aguda y absceso intracardíaco [115]. Además, se observaron complicaciones supurativas metastásicas distantes que requieren drenaje quirúrgico en el 25 por ciento de los casos [115].
Los pacientes con infecciones metastásicas en el hígado, órganos abdominales, o columna vertebral debido a S. anginosus pueden o no pueden tener endocarditis. En tales casos, la ecocardiografía puede estar justificada para determinar si la infección metastásica es secundaria a una fuente endovascular.
BACTERIEMIA
La bacteriemia causada por miembros del grupo anginosus S. es con frecuencia el resultado de un enfoque de identificación de la infección. Hemocultivos positivos deberían llevar a la evaluación de la infección metastásica como se describe en las secciones anteriores, incluyendo absceso intraabdominal, infecciones profundas de cabeza y cuello, absceso cerebral, y / o endocarditis [13,37,50-53].
En ausencia de endocarditis o complicaciones supurativas metastásicas, la bacteriemia tiene buen pronóstico. La terapia antimicrobiana debe consistir en una cefalosporina de tercera generación, tales como cefotaxima o ceftriaxona durante al menos dos semanas.
OTRAS INFECCIONES
Otras infecciones causadas por grupo anginosus S. aislados incluir la sinusitis, infecciones de piel y tejidos blandos, osteomielitis, artritis séptica, y piomiositis [118-121]. El tratamiento consiste en una terapia antimicrobiana y drenaje si es necesario. La duración del tratamiento depende del sitio de la infección.
La terapia antimicrobiana - Tratamiento de las infecciones causadas por los miembros del grupo anginosus S. debe incluir terapia antimicrobiana y evaluación con respecto a la cirugía para el desbridamiento / drenaje.
El tratamiento de la infección por los miembros del grupo anginosus S. debe guiarse por los estudios de susceptibilidad en la literatura médica; muchos laboratorios clínicos no realizan rutinariamente pruebas de susceptibilidad antimicrobiana de estos organismos.
Los miembros del grupo anginosus S. son en gran medida susceptibles a los agentes beta-lactámicos. La concentración mínima inhibitoria (CIM) a la penicilina G son generalmente ≤0.125 mcg / ml [122123]. / Ml se han reportado algunas cepas con CIM de penicilina G entre 0,25 y 2 mcg; cepas raras tienen MIC penicilina ≥4 mcg / mL. La penicilina-intermedio o cepas resistentes han alterado las proteínas de unión a penicilina; estos son más propensos a ser S. anginosus o S. intermedius de S. constellatus. En caso de alergia o la resistencia o sensibilidad impide el uso de agentes beta-lactámicos, la vancomicina es un agente alternativo adecuado. La duración del tratamiento depende de la naturaleza de la infección como se discute en las siguientes secciones.
Análisis retrospectivo de la terapia para los abscesos cerebrales y bacteriemia por miembros del grupo anginosus S. sugiere que se prefiere una cefalosporina de tercera generación como ceftriaxona o cefotaxima.
La CIM de fluoroquinolona entre los miembros del grupo S. anginosus son altos, pero en el rango susceptible (0,5 a 1,0 mcg / ml); resistencia tiende a desarrollar fácilmente y por lo tanto no fluoroquinolonas son agentes antimicrobianos primera línea apropiados [124125]. La resistencia a macrólidos parece estar surgiendo entre el grupo anginosus S. [122,126-128]. La mayoría de las cepas del grupo anginosus S. son resistentes a los aminoglucósidos [99115]. Las sulfonamidas no tienen actividad contra el grupo anginosus S. aislamientos.
Si se sospecha y / o confirmada por tinción de Gram y cultivo de resultados infección mixta, otros microorganismos tales como bacterias anaerobias deben ser tratados con un régimen antimicrobiano apropiado mediante la adición de metronidazol o clindamicina a uno de los agentes anteriores, el tratamiento, ya sea con un betalactámico / beta combinación de inhibidores de lactamasa, o tratar con un carbapenem.
Presentó
Dra Verónica Covatti
Médica Residente
Servicio de Clínica Médica
Hospital Municipal “Dr Ángel Pintos” de Azul
Ruoff KL. Streptococcus anginosus ("Streptococcus milleri"): the unrecognized pathogen. Clin Microbiol Rev 1988; 1:102.
Whiley RA, Beighton D. Emended descriptions and recognition of Streptococcus constellatus, Streptococcus intermedius, and Streptococcus anginosus as distinct species. Int J Syst Bacteriol 1991; 41:1.
Whiley RA, Hall LM, Hardie JM, Beighton D. A study of small-colony, beta-haemolytic, Lancefield group C streptococci within the anginosus group: description of Streptococcus constellatus subsp. pharyngis subsp. nov., associated with the human throat and pharyngitis. Int J Syst Bacteriol 1999; 49 Pt 4:1443.
Whiley RA, Fraser H, Hardie JM, Beighton D. Phenotypic differentiation of Streptococcus intermedius, Streptococcus constellatus, and Streptococcus anginosus strains within the "Streptococcus milleri group". J Clin Microbiol 1990; 28:1497.
Whiley RA, Beighton D, Winstanley TG, et al. Streptococcus intermedius, Streptococcus constellatus, and Streptococcus anginosus (the Streptococcus milleri group): association with different body sites and clinical infections. J Clin Microbiol 1992; 30:243.
Claridge JE 3rd, Attorri S, Musher DM, et al. Streptococcus intermedius, Streptococcus constellatus, and Streptococcus anginosus ("Streptococcus milleri group") are of different clinical importance and are not equally associated with abscess. Clin Infect Dis 2001; 32:1511.
GUTHOF O. [Pathogenic strains of Streptococcus viridans; streptocci found in dental abscesses and infiltrates in the region of the oral cavity]. Zentralbl Bakteriol Orig 1956; 166:553.
Mejàre B, Edwardsson S. Streptococcus milleri (Guthof); an indigenous organism of the human oral cavity. Arch Oral Biol 1975; 20:757.
Mejàre B. Characteristics of Streptococcus milleri and Streptococcus mitior from infected dental root canals. Odontol Revy 1975; 26:291.
Parker MT, Ball LC. Streptococci and aerococci associated with systemic infection in man. J Med Microbiol 1976; 9:275.
Bateman NT, Eykyn SJ, Phillips I. Pyogenic liver abscess caused by Streptococcus milleri. Lancet 1975; 1:657.
Melo JC, Raff MJ. Brain abscess due to Streptococcus MG-intermedius (Streptococcus milleri). J Clin Microbiol 1978; 7:529.
Gossling J. Occurrence and pathogenicity of the Streptococcus milleri group. Rev Infect Dis 1988; 10:257.
Jackson DS, Welch DF, Pickett DA, et al. Suppurative infections in children caused by non-beta-hemolytic members of the Streptococcus milleri group. Pediatr Infect Dis J 1995; 14:80.
Belko J, Goldmann DA, Macone A, Zaidi AK. Clinically significant infections with organisms of the Streptococcus milleri group. Pediatr Infect Dis J 2002; 21:715.
Doern CD, Burnham CA. It's not easy being green: the viridans group streptococci, with a focus on pediatric clinical manifestations. J Clin Microbiol 2010; 48:3829.
Spellerberg B, Brandt C. Streptococcus. In: Manual of Clinical Microbiology, 9th ed, Murray PR, Baron EJ, Jorgenson JH, et al (Eds), ASM Press, Washington, DC 2009. Vol 1, p.412.
Poole PM, Wilson G. Infection with minute-colony-forming beta-haemolytic streptococci. J Clin Pathol 1976; 29:740.
Brogan O, Malone J, Fox C, Whyte AS. Lancefield grouping and smell of caramel for presumptive identification and assessment of pathogenicity in the Streptococcus milleri group. J Clin Pathol 1997; 50:332.
Petti C, Stratton CW. Streptococcus anginosus group. In: Principles and Practice of Infectious Diseases, 7th Ed, Mandell GL, Bennett JE, Dolin R (Eds), Churchill Livingstone, New York, NY 2009. p.2681.
Hinnebusch CJ, Nikolai DM, Bruckner DA. Comparison of API Rapid Strep, Baxter MicroScan Rapid Pos ID Panel, BBL Minitek Differential Identification System, IDS RapID STR System, and Vitek GPI to conventional biochemical tests for identification of viridans streptococci. Am J Clin Pathol 1991; 96:459.
Hoshino T, Fujiwara T, Kilian M. Use of phylogenetic and phenotypic analyses to identify nonhemolytic streptococci isolated from bacteremic patients. J Clin Microbiol 2005; 43:6073.
Brigante G, Luzzaro F, Bettaccini A, et al. Use of the Phoenix automated system for identification of Streptococcus and Enterococcus spp. J Clin Microbiol 2006; 44:3263.
Summanen PH, Rowlinson MC, Wooton J, Finegold SM. Evaluation of genotypic and phenotypic methods for differentiation of the members of the Anginosus group streptococci. Eur J Clin Microbiol Infect Dis 2009; 28:1123.
Nielsen XC, Justesen US, Dargis R, et al. Identification of clinically relevant nonhemolytic Streptococci on the basis of sequence analysis of 16S-23S intergenic spacer region and partial gdh gene. J Clin Microbiol 2009; 47:932.
Friedrichs C, Rodloff AC, Chhatwal GS, et al. Rapid identification of viridans streptococci by mass spectrometric discrimination. J Clin Microbiol 2007; 45:2392.
Petti CA, Simmon KE, Bender J, et al. Culture-Negative intracerebral abscesses in children and adolescents from Streptococcus anginosus group infection: a case series. Clin Infect Dis 2008; 46:1578.
Willcox MD, Knox KW. Surface-associated properties of Streptococcus milleri group strains and their potential relation to pathogenesis. J Med Microbiol 1990; 31:259.
Kitada K, Inoue M, Kitano M. Experimental endocarditis induction and platelet aggregation by Streptococcus anginosus, Streptococcus constellatus and Streptococcus intermedius. FEMS Immunol Med Microbiol 1997; 19:25.
Toyoda K, Kusano N, Saito A. Pathogenicity of the Streptococcus milleri group in pulmonary infections--effect on phagocytic killing by human polymorphonuclear neutrophils. Kansenshogaku Zasshi 1995; 69:308.
Shinzato T, Saito A. A mechanism of pathogenicity of "Streptococcus milleri group" in pulmonary infection: synergy with an anaerobe. J Med Microbiol 1994; 40:118.
Young KA, Allaker RP, Hardie JM, Whiley RA. Interactions between Eikenella corrodens and 'Streptococcus milleri-group' organisms: possible mechanisms of pathogenicity in mixed infections. Antonie Van Leeuwenhoek 1996; 69:371.
Nagashima H, Takao A, Maeda N. Abscess forming ability of streptococcus milleri group: synergistic effect with Fusobacterium nucleatum. Microbiol Immunol 1999; 43:207.
Nagamune H, Whiley RA, Goto T, et al. Distribution of the intermedilysin gene among the anginosus group streptococci and correlation between intermedilysin production and deep-seated infection with Streptococcus intermedius. J Clin Microbiol 2000; 38:220.
Jacobs JA, Stobberingh EE. Hydrolytic enzymes of Streptococcus anginosus, Streptococcus constellatus and Streptococcus intermedius in relation to infection. Eur J Clin Microbiol Infect Dis 1995; 14:818.
Wanahita A, Goldsmith EA, Musher DM, et al. Interaction between human polymorphonuclear leukocytes and Streptococcus milleri group bacteria. J Infect Dis 2002; 185:85.
Bert F, Bariou-Lancelin M, Lambert-Zechovsky N. Clinical significance of bacteremia involving the "Streptococcus milleri" group: 51 cases and review. Clin Infect Dis 1998; 27:385.
Stelzmueller I, Pfausler B, Fille M, et al. Streptococcus milleri group isolates from blood cultures: consider surgical sepsis. Surg Infect (Larchmt) 2009; 10:259.
Ruoff KL, Kunz LJ, Ferraro MJ. Occurrence of Streptococcus milleri among beta-hemolytic streptococci isolated from clinical specimens. J Clin Microbiol 1985; 22:149.
Drucker DB, Green RM. Dental caries induced by Streptococcus milleri. J Dent Res 1977; 56:1062.
Rawlinson A, Duerden BI, Goodwin L. New findings on the microbial flora associated with adult periodontitis. J Dent 1993; 21:179.
Hidaka H, Kuriyama S, Yano H, et al. Precipitating factors in the pathogenesis of peritonsillar abscess and bacteriological significance of the Streptococcus milleri group. Eur J Clin Microbiol Infect Dis 2011; 30:527.
Williams BL, McCann GF, Schoenknecht FD. Bacteriology of dental abscesses of endodontic origin. J Clin Microbiol 1983; 18:770.
Bancescu G, Lofthus B, Hofstad T, et al. Isolation and characterization of "Streptococcus milleri" group strains from oral and maxillofacial infections. Adv Exp Med Biol 1997; 418:165.
Cimolai N, MacCulloch L, Damm S. The epidemiology of beta-haemolytic non-group A streptococci isolated from the throats of children over a one-year period. Epidemiol Infect 1990; 104:119.
Turner JC, Hayden GF, Kiselica D, et al. Association of group C beta-hemolytic streptococci with endemic pharyngitis among college students. JAMA 1990; 264:2644.
Turner JC, Hayden FG, Lobo MC, et al. Epidemiologic evidence for Lancefield group C beta-hemolytic streptococci as a cause of exudative pharyngitis in college students. J Clin Microbiol 1997; 35:1.
Hamrick HJ, Mangum ME. Beta-hemolytic Streptococcus milleri group misidentified as Streptococcus pyogenes on throat culture. Pediatr Infect Dis J 1999; 18:75.
Jensen A, Hoshino T, Kilian M. Taxonomy of the Anginosus group of the genus Streptococcus and description of Streptococcus anginosus subsp. whileyi subsp. nov. and Streptococcus constellatus subsp. viborgensis subsp. nov. Int J Syst Evol Microbiol 2013; 63:2506.
Salavert M, Gómez L, Rodriguez-Carballeira M, et al. Seven-year review of bacteremia caused by Streptococcus milleri and other viridans streptococci. Eur J Clin Microbiol Infect Dis 1996; 15:365.
Casariego E, Rodriguez A, Corredoira JC, et al. Prospective study of Streptococcus milleri bacteremia. Eur J Clin Microbiol Infect Dis 1996; 15:194.
Jacobs JA, Pietersen HG, Stobberingh EE, Soeters PB. Bacteremia involving the "Streptococcus milleri" group: analysis of 19 cases. Clin Infect Dis 1994; 19:704.
Seifert H. The clinical importance of microbiological findings in the diagnosis and management of bloodstream infections. Clin Infect Dis 2009; 48 Suppl 4:S238.
Felsenstein S, Williams B, Shingadia D, et al. Clinical and microbiologic features guiding treatment recommendations for brain abscesses in children. Pediatr Infect Dis J 2013; 32:129.
Herr RD, Murdock RT, Davis RK. Serious soft tissue infections of the head and neck. Am Fam Physician 1991; 44:878.
Johnson JT. Abscesses and deep space infections of the head and neck. Infect Dis Clin North Am 1992; 6:705.
Han JK, Kerschner JE. Streptococcus milleri: an organism for head and neck infections and abscess. Arch Otolaryngol Head Neck Surg 2001; 127:650.
Hirai T, Kimura S, Mori N. Head and neck infections caused by Streptococcus milleri group: an analysis of 17 cases. Auris Nasus Larynx 2005; 32:55.
Reynolds SC, Chow AW. Severe soft tissue infections of the head and neck: a primer for critical care physicians. Lung 2009; 187:271.
Pearson CR, Riden DK, Garth RJ, Thomas MR. Two cases of lateral sinus thrombosis presenting with extracranial head and neck abscesses. J Laryngol Otol 1994; 108:779.
Watkins LM, Pasternack MS, Banks M, et al. Bilateral cavernous sinus thromboses and intraorbital abscesses secondary to Streptococcus milleri. Ophthalmology 2003; 110:569.
Udaondo P, Garcia-Delpech S, Díaz-Llopis M, et al. Bilateral intraorbital abscesses and cavernous sinus thromboses secondary to Streptococcus milleri with a favorable outcome. Ophthal Plast Reconstr Surg 2008; 24:408.
Mathisen GE, Johnson JP. Brain abscess. Clin Infect Dis 1997; 25:763.
Jones RL, Violaris NS, Chavda SV, Pahor AL. Intracranial complications of sinusitis: the need for aggressive management. J Laryngol Otol 1995; 109:1061.
Bair-Merritt MH, Shah SS, Zaoutis TE, et al. Suppurative intracranial complications of sinusitis in previously healthy children. Pediatr Infect Dis J 2005; 24:384.
Deutschmann MW, Livingstone D, Cho JJ, et al. The significance of Streptococcus anginosus group in intracranial complications of pediatric rhinosinusitis. JAMA Otolaryngol Head Neck Surg 2013; 139:157.
Oxford LE, McClay J. Medical and surgical management of subperiosteal orbital abscess secondary to acute sinusitis in children. Int J Pediatr Otorhinolaryngol 2006; 70:1853.
McKinley SH, Yen MT, Miller AM, Yen KG. Microbiology of pediatric orbital cellulitis. Am J Ophthalmol 2007; 144:497.
Beech T, Robinson A, McDermott AL, Sinha A. Paediatric periorbital cellulitis and its management. Rhinology 2007; 45:47.
Bambakidis NC, Cohen AR. Intracranial complications of frontal sinusitis in children: Pott's puffy tumor revisited. Pediatr Neurosurg 2001; 35:82.
Tsai BY, Lin KL, Lin TY, et al. Pott's puffy tumor in children. Childs Nerv Syst 2010; 26:53.
Parida PK, Surianarayanan G, Ganeshan S, Saxena SK. Pott's puffy tumor in pediatric age group: a retrospective study. Int J Pediatr Otorhinolaryngol 2012; 76:1274.
Goldenberg NA, Knapp-Clevenger R, Hays T, Manco-Johnson MJ. Lemierre's and Lemierre's-like syndromes in children: survival and thromboembolic outcomes. Pediatrics 2005; 116:e543.
Ridgway JM, Parikh DA, Wright R, et al. Lemierre syndrome: a pediatric case series and review of literature. Am J Otolaryngol 2010; 31:38.
Brook I. Fusobacterial infections in children. J Infect 1994; 28:155.
Centor RM, Geiger P, Waites KB. Fusobacterium necrophorum bacteremic tonsillitis: 2 Cases and a review of the literature. Anaerobe 2010; 16:626.
Chun CH, Johnson JD, Hofstetter M, Raff MJ. Brain abscess. A study of 45 consecutive cases. Medicine (Baltimore) 1986; 65:415.
Carpenter J, Stapleton S, Holliman R. Retrospective analysis of 49 cases of brain abscess and review of the literature. Eur J Clin Microbiol Infect Dis 2007; 26:1.
Gelfand MS, Bakhtian BJ, Simmons BP. Spinal sepsis due to Streptococcus milleri: two cases and review. Rev Infect Dis 1991; 13:559.
Darouiche RO, Hamill RJ, Greenberg SB, et al. Bacterial spinal epidural abscess. Review of 43 cases and literature survey. Medicine (Baltimore) 1992; 71:369.
Dhariwal DK, Patton DW, Gregory MC. Epidural spinal abscess following dental extraction--a rare and potentially fatal complication. Br J Oral Maxillofac Surg 2003; 41:56.
Greenlee JE. Subdural Empyema. Curr Treat Options Neurol 2003; 5:13.
Cabellos C, Viladrich PF, Corredoira J, et al. Streptococcal meningitis in adult patients: current epidemiology and clinical spectrum. Clin Infect Dis 1999; 28:1104.
Ziai WC, Lewin JJ 3rd. Update in the diagnosis and management of central nervous system infections. Neurol Clin 2008; 26:427.
Smith SJ, Ughratdar I, MacArthur DC. Never go to sleep on undrained pus: a retrospective review of surgery for intraparenchymal cerebral abscess. Br J Neurosurg 2009; 23:412.
Jansson AK, Enblad P, Sjölin J. Efficacy and safety of cefotaxime in combination with metronidazole for empirical treatment of brain abscess in clinical practice: a retrospective study of 66 consecutive cases. Eur J Clin Microbiol Infect Dis 2004; 23:7.
Kowlessar PI, O'Connell NH, Mitchell RD, et al. Management of patients with Streptococcus milleri brain abscesses. J Infect 2006; 52:443.
Allison HF, Immelman EJ, Forder AA. Pyogenic liver abscess caused by Streptococcus milleri. Case reports. S Afr Med J 1984; 65:432.
Corredoira J, Casariego E, Moreno C, et al. Prospective study of Streptococcus milleri hepatic abscess. Eur J Clin Microbiol Infect Dis 1998; 17:556.
Molina JM, Leport C, Bure A, et al. Clinical and bacterial features of infections caused by Streptococcus milleri. Scand J Infect Dis 1991; 23:659.
Poole PM, Wilson G. Streptococcus milleri in the appendix. J Clin Pathol 1977; 30:937.
Madden NP, Hart CA. Streptococcus milleri in appendicitis in children. J Pediatr Surg 1985; 20:6.
Hardwick RH, Taylor A, Thompson MH, et al. Association between Streptococcus milleri and abscess formation after appendicitis. Ann R Coll Surg Engl 2000; 82:24.
Admon D, Gottehrer N, Leitersdorf E. Is "primary" subphrenic abscess caused by Streptococcus milleri a result of unrecognized gastrointestinal perforation? Klin Wochenschr 1986; 64:287.
Rautio M, Saxén H, Siitonen A, et al. Bacteriology of histopathologically defined appendicitis in children. Pediatr Infect Dis J 2000; 19:1078.
Guillet-Caruba C, Cheikhelard A, Guillet M, et al. Bacteriologic epidemiology and empirical treatment of pediatric complicated appendicitis. Diagn Microbiol Infect Dis 2011; 69:376.
Schmitt F, Clermidi P, Dorsi M, et al. Bacterial studies of complicated appendicitis over a 20-year period and their impact on empirical antibiotic treatment. J Pediatr Surg 2012; 47:2055.
Seeto RK, Rockey DC. Pyogenic liver abscess. Changes in etiology, management, and outcome. Medicine (Baltimore) 1996; 75:99.
Stelzmueller I, Biebl M, Berger N, et al. Relevance of group Milleri streptococci in thoracic surgery: a clinical update. Am Surg 2007; 73:492.
Shinzato T, Saito A. The Streptococcus milleri group as a cause of pulmonary infections. Clin Infect Dis 1995; 21 Suppl 3:S238.
Wong CA, Donald F, Macfarlane JT. Streptococcus milleri pulmonary disease: a review and clinical description of 25 patients. Thorax 1995; 50:1093.
Porta G, Rodríguez-Carballeira M, Gómez L, et al. Thoracic infection caused by Streptococcus milleri. Eur Respir J 1998; 12:357.
Marinella MA, Harrington GD, Standiford TJ. Empyema necessitans due to Streptococcus milleri. Clin Infect Dis 1996; 23:203.
Shishido H, Watanabe K, Matsumoto K, et al. Primary purulent mediastinitis due to Streptococcus milleri. Respiration 1997; 64:313.
Waite RD, Wareham DW, Gardiner S, Whiley RA. A simple, semiselective medium for anaerobic isolation of anginosus group streptococci from patients with chronic lung disease. J Clin Microbiol 2012; 50:1430.
Sibley CD, Parkins MD, Rabin HR, et al. A polymicrobial perspective of pulmonary infections exposes an enigmatic pathogen in cystic fibrosis patients. Proc Natl Acad Sci U S A 2008; 105:15070.
Parkins MD, Sibley CD, Surette MG, Rabin HR. The Streptococcus milleri group--an unrecognized cause of disease in cystic fibrosis: a case series and literature review. Pediatr Pulmonol 2008; 43:490.
Parkins MD, Sibley CD, Surette MG, et al. Streptococcus milleri endobronchial colonization is associated with an increased rate of pulmonary disease in cystic fibrosis. Pediatr Pulmonol 2008; 43:S339.
Rabin HR, Surette MG. The cystic fibrosis airway microbiome. Curr Opin Pulm Med 2012; 18:622.
Sibley CD, Grinwis ME, Field TR, et al. McKay agar enables routine quantification of the 'Streptococcus milleri' group in cystic fibrosis patients. J Med Microbiol 2010; 59:534.
Olson AB, Sibley CD, Schmidt L, et al. Development of real-time PCR assays for detection of the Streptococcus milleri group from cystic fibrosis clinical specimens by targeting the cpn60 and 16S rRNA genes. J Clin Microbiol 2010; 48:1150.
Grinwis ME, Sibley CD, Parkins MD, et al. Characterization of Streptococcus milleri group isolates from expectorated sputum of adult patients with cystic fibrosis. J Clin Microbiol 2010; 48:395.
Ripley RT, Cothren CC, Moore EE, et al. Streptococcus milleri infections of the pleural space: operative management predominates. Am J Surg 2006; 192:817.
Reimel BA, Krishnadasen B, Cuschieri J, et al. Surgical management of acute necrotizing lung infections. Can Respir J 2006; 13:369.
Lefort A, Lortholary O, Casassus P, et al. Comparison between adult endocarditis due to beta-hemolytic streptococci (serogroups A, B, C, and G) and Streptococcus milleri: a multicenter study in France. Arch Intern Med 2002; 162:2450.
Woo PC, Tse H, Chan KM, et al. "Streptococcus milleri" endocarditis caused by Streptococcus anginosus. Diagn Microbiol Infect Dis 2004; 48:81.
Levandowski RA. Streptococcus milleri endocarditis complicated by myocardial abscess. South Med J 1985; 78:892.
Stocker E, Cortes E, Pema K, et al. Streptococcus milleri as a cause of antecubital abscess and bacteremia in intravenous drug abusers. South Med J 1994; 87:95.
Calza L, Manfredi R, Briganti E, et al. Iliac osteomyelitis and gluteal muscle abscess caused by Streptococcus intermedius. J Med Microbiol 2001; 50:480.
Ortel TL, Kallianos J, Gallis HA. Group C streptococcal arthritis: case report and review. Rev Infect Dis 1990; 12:829.
Yassin M, Yadavalli GK, Alvarado N, Bonomo RA. Streptococcus anginosus (Streptococcus milleri Group) Pyomyositis in a 50-Year-Old Man with Acquired Immunodeficiency Syndrome: Case Report and Review of Literature. Infection 2010; 38:65.
Tracy M, Wanahita A, Shuhatovich Y, et al. Antibiotic susceptibilities of genetically characterized Streptococcus milleri group strains. Antimicrob Agents Chemother 2001; 45:1511.
Bantar C, Fernandez Canigia L, Relloso S, et al. Species belonging to the "Streptococcus milleri" group: antimicrobial susceptibility and comparative prevalence in significant clinical specimens. J Clin Microbiol 1996; 34:2020.
Yamamoto N, Fujita J, Shinzato T, et al. In vitro activity of sitafloxacin compared with several fluoroquinolones against Streptococcus anginosus and Streptococcus constellatus. Int J Antimicrob Agents 2006; 27:171.
Kaneko A, Sasaki J, Shimadzu M, et al. Comparison of gyrA and parC mutations and resistance levels among fluoroquinolone-resistant isolates and laboratory-derived mutants of oral streptococci. J Antimicrob Chemother 2000; 45:771.
Jacobs JA, van Baar GJ, London NH, et al. Prevalence of macrolide resistance genes in clinical isolates of the Streptococcus anginosus ("S. milleri") group. Antimicrob Agents Chemother 2001; 45:2375.
Asmah N, Eberspächer B, Regnath T, Arvand M. Prevalence of erythromycin and clindamycin resistance among clinical isolates of the Streptococcus anginosus group in Germany. J Med Microbiol 2009; 58:222.
Limia A, Jiménez ML, Alarcón T, López-Brea M. Five-year analysis of antimicrobial susceptibility of the Streptococcus milleri group. Eur J Clin Microbiol Infect Dis 1999; 18:440.
Topic 3178 Version 8.0