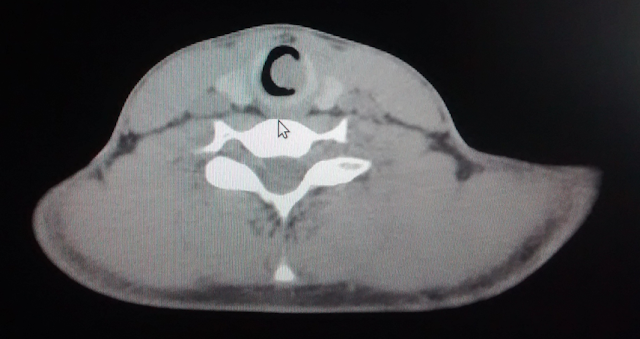
La disección aórtica se caracteriza por la creación de una falsa luz en la capa media de la pared aórtica. Dependiendo de la presencia y localización de los desgarros primitivos, así como la extensión retrógrada o anterógrada de la disección, se clasifican los tipos de disección. El grupo de Stanford habla de tipos A y B según la aorta ascendente esté afectada o no por la disección, respectivamente. DeBakey diferencia entre el tipo I cuando la aorta ascendente y descendente están afectadas, tipo II cuando sólo interesa la aorta ascendente y tipo III cuando sólo se afecta la aorta descendente.
La disección aórtica (DAo) típica comienza con la formación de un desgarro en la íntima de la aorta, que expone la capa media subyacente enferma al flujo sanguíneo pulsátil. Éste penetra en dicha capa media, disecándola y extendiéndose distalmente en longitud variable, creando una falsa luz; de forma ocasional se extiende proximalmente.
Fuerzas de cizallamiento pueden producir desgarro de la parte interna de la pared aórtica disecada (flap intimal) produciendo zonas de salida o entrada adicionales. La distensión de la falsa luz puede llegar a estenosar y distorsionar la luz aórtica verdadera.
La localización del desgarro intimal primario más frecuente es la aorta ascendente, entre 1-5 cm por encima del seno de Valsalva derecho en el 65% de los casos, en la aorta descendente proximal debajo de la subclavia izquierda en el 20%, en el arco aórtico transverso en 10% y en aorta distal toracoabdominal en el 5%.
Recientemente se han descrito otras dos formas etiológicas de DAo: el hematoma intramural (HI) y la úlcera aórtica aterosclerótica penetrante (UP).
El HI, también conocido como DAo sin desgarro intimal, es esencialmente una hemorragia contenida en la capa media aórtica, extendida hasta la adventicia, que es producida por rotura de los vasa vasorum. Correspondería al 3-13% de las disecciones sin desgarro intimal de los estudios patológicos antiguos.
La UP, como su nombre indica, sería una ulceración de una lesión arteriosclerótica aórtica que penetra en la lámina elástica interna, formando un hematoma en la capa media de la aorta torácica descendente, permaneciendo localizado o extendiéndose unos centímetros, sin formar una segunda luz.
Frecuentemente originan aneurismas aórticos saculares o fusiformes. En el 25% de los casos causan pseudoaneurisma aórtico y en un 8% conducen a rotura aórtica. La progresión a una DAo extensa es rara.
Existen factores predisponentes de disección aórtica, como la edad, hipertensión sistémica arterial (HTA), anomalías congénitas de la válvula aórtica, trastornos hereditarios del sistema conectivo, traumáticos y otros. La DAo afecta a pacientes entre la quinta y séptima décadas de la vida, siendo más frecuente en varones (3/1). En menores de 40 años la frecuencia es similar en ambos sexos, debido a la mayor frecuencia de DAo en mujeres durante el tercer trimestre del embarazo.
La HTA es encontrada en el 80% de los casos, siendo el segundo factor predisponente en importancia. La degeneración medial quística es un signo intrínseco de varios trastornos hereditarios del tejido conectivo, más notablemente el síndrome de Marfan y el de Ehlers-Danlos, donde se produce un deterioro del colágeno y la elastina medial que sería el factor predisponente principal de la mayoría de las DAo no traumáticas. Los pacientes con síndrome de Marfan, además de su propensión al desarrollo de aneurismas aórticos torácicos, tienen alto riesgo de DAo en una edad relativamente joven. La ectasia anuloaórtica con dilatación idiopática de la aorta ascendente e insuficiencia aórtica tiene su origen en la degeneración medial quística, y predispone igualmente a la DAo.
Las DAo iatrógenas son complicaciones infrecuentes, pero potencialmente serias después de angiografías o cirugía. Las primeras son secundarias a coronariografías, aortografías, inserción de balón de contrapulsación, se localizan en el seno de Valsalva, arterias braquiales, cefálicas, ilíacas y femorales; la mayoría son retrógradas y disminuyen de tamaño por trombosis de la falsa luz, mientras que las anterógradas persisten en el seguimiento y pueden ser tratadas de forma médica. Las DAo secundarias a cirugía cardíaca son intraoperatorias y se diagnostican y tratan de forma precoz.
Los traumatismos aórticos directos tienden a causar desgarros localizados, hematomas o roturas aórticas francas más que DAo clásicas. Otros factores y enfermedades asociadas a DAo serían: síndromes de Turner y de Noonan, aortitis de células gigantes, lupus, displasia fibromuscular, poliarteritis nodosa, enfermedad poliquística renal y la ingestión de cocaína.
PRESENTACIÓN CLÍNICA
El síntoma más frecuente es el dolor severo, de comienzo súbito, de carácter desgarrante, de tipo pulsátil, migratorio siguiendo el sentido de la disección, localizado en la cara anterior del tórax, cuello y mandíbula cuando la DAo esta en la aorta proximal, o localizado en la zona interescapular y el abdomen si la DAo es distal, acompañado de apariencia de shock con tensiones arteriales conservadas o altas.
Síntomas menos comunes en la presentación de la DAo, con o sin dolor torácico asociado, serían:
- Fallo cardíaco debido a insuficiencia aórtica severa en las DAo proximales.
-Síncope sin signos neurológicos focales por rotura de DAo proximal en la cavidad pericárdica con taponamiento o, con menos frecuencia, por rotura de disección aórtica descendente en el espacio pleural izquierdo.
- Accidente vascular cerebral, neuropatías periféricas o paraplejía.
- Parada cardíaca o muerte súbita.
EXPLORACIÓN FÍSICA
Los signos generalmente reflejan la localización de la DAo y el grado de afectación cardiovascular. Sugieren el diagnóstico aunque pueden ser sutiles o ausentes aun en presencia de DAo extensa.
La HTA aparece en 80-90% de las DAo distales, siendo menos común en las proximales. La hipotensión arterial verdadera es más frecuente en las proximales, por taponamiento cardíaco, aunque las DAo distales también producen hipotensión arterial por rotura intrapleural o intraperitoneal. Cuando la disección ocluye vasos braquiocefálicos podemos registrar de forma inexacta una hipotensión arterial (seudohipotensión).
Los signos físicos típicos asociados a DAo son más característicos cuando se afecta la aorta proximal. Éstos serían:
- Déficit de pulsos (un 50% en la DAo proximal y un 15% en la DAo distal) por oclusión de la luz vascular por el flap o por extensión de la disección misma en la arteria y compromiso de la luz verdadera por el falso canal. A veces, los déficit de pulsos son transitorios por reentrada distal o movimientos del flap intimal.
-La insuficiencia aórtica (IAo) es un signo importante de la DAo proximal (50-66%) con soplo de calidad musical en el borde esternal derecho con intensidad dependiente de la presión arterial. Por el fallo cardíaco asociado puede apagarse el soplo y los signos periféricos de la insuficiencia aórtica. En su origen participa la dilatación del anillo y la raíz aórtica, depresión de una valva, prolapso del flap y torsión del anillo.
-Manifestaciones neurológicas (6-19%): puede ocurrir accidente cerebrovascular en el 3-6% por afectación directa de la arteria innominada o carótida común; con menos frecuencia coma, paraplejía y paraparesia.
-Infarto agudo de miocardio (IAM) (1-2%) de cara inferior, por afectación del ostium de la coronaria por el flap. La disección puede no ser reconocida, con consecuencias catastróficas si es tratada con trombolíticos.
-Infarto renal, fracaso renal y HTA severa por compromiso de la arteria renal (5-8%).
-Isquemia e infarto mesentérico (3-5%).
-Déficit de pulsos femorales (12%) por compromiso de las arterias ilíacas, con dolor torácico mínimo que nos puede confundir con embolismo periférico.
-Otras manifestaciones clínicas pueden ser hemotórax, hemoptisis y hematemesis por roturas en el espacio pleural, bronquios o esófago. Ocasionalmente se han descrito roturas en la aurícula derecha o izquierda, en el ventrículo derecho con fallo cardíaco.
-Síndrome de vena cava superior, pulsación esternoclavicular, masa pulsátil cervical y síndrome de Horner.
El hematoma intramural tiene una clínica indistinguible de la DAo aguda. Son pacientes de edad similar, con historia de HTA y arteriosclerosis aórtica extensa, con dolor torácico y dorsal típico de la DAo clásica, con insuficiencia aórtica y déficit de pulsos. El 50% presentan derrame pleural izquierdo al cabo de unos días de evolución. El derrame pericárdico puede aparecer cuando la aorta ascendente está afectada.
Los pacientes con úlcera penetrante son igualmente de edad avanzada, con historia de HTA y arteriosclerosis cardiovascular, con dolor torácico dorsal, sin déficit de pulsos, insuficiencia aórtica ni déficit neurológicos.
En general, la DAo proximal se presenta con dolor inicial torácico anterior, soplo diastólico aórtico, roce pericárdico, ausencia o disminución del pulso y presión arterial en el brazo derecho, carótida derecha con pulso disminuido, isquemia o infarto agudo de miocardio, síndrome de Marfan y con anomalías congénitas de la válvula aórtica. La DAo distal se presenta con dolor interescapular, HTA con más frecuencia y derrame pleural izquierdo.
El diagnóstico diferencial de la DAo debemos establecerlo con:
-Aneurismas aórticos toracoabdominales no disecados.
-Isquemia e infarto agudo de miocardio.
-Insuficiencia aórtica sin disección.
-Pericarditis aguda.
-Tumor mediastínico.
MÉTODOS DIAGNÓSTICOS
Debido a que la disección de aorta es una entidad con muy diversas formas de presentación clínica es necesario mantener un alto índice de sospecha por parte del médico para establecer un diagnóstico rápido y exacto. Los tres factores clínicos más frecuentemente asociados a la disección de aorta son la historia previa de hipertensión arterial, el comienzo súbito de dolor torácico intenso y la irradiación del dolor 1. Estos factores, junto con un electrocardiograma normal, la presión arterial alta en el momento de la anamnesis, la ausencia de alguno de los pulsos periféricos, el soplo de insuficiencia aórtica y el ensanchamiento mediastínico evidenciado en la placa de tórax obligan al clínico a descartar la disección de aorta.
No existe una prueba de elección en la evaluación de la disección de aorta, pues las técnicas disponibles tienen ventajas e inconvenientes, de forma que cada una de la técnicas será más completa en el estudio de algunos de los diferentes aspectos diagnósticos (tabla 1).
Electrocardiograma
El electrocardiograma es normal en la mayoría de los casos. En pacientes muy hipertensos puede poner de manifiesto signos de hipertrofia ventricular izquierda. Aunque el electrocardiograma no apoya el diagnóstico de disección de aorta, es esencial para distinguir esta entidad del infarto agudo de miocardio, puesto que el cuadro clínico puede ser muy parecido. Hay que reseñar que en los casos en los que el flap diseque la coronaria el ECG puede evidenciar la signos de IAM.
Radiografía de tórax
Aunque se ha sugerido que la radiografía de tórax adecuadamente realizada e interpretada por expertos tiene una alta precisión diagnóstica 2, la realidad es que en menos del 30% de pacientes existen signos inequívocos de disección 3. Sin embargo, se acepta que en el proceso diagnóstico es esencial contar con una radiografía de tórax porque no sólo puede ofrecer signos compatibles y apoyar, por tanto, la necesidad de realizar otra prueba de imagen para confirmar el diagnóstico, sino que también puede identificar otras causas de dolor torácico. Por otra parte, se reconoce una alta variabilidad interobservador 2, por lo que no debe ser la única prueba de imagen ante una sospecha de disección.
Los signos radiográficos que sugieren disección de aorta son 2: borramiento o ensanchamiento del botón aórtico, derrame pleural (generalmente izquierdo), desviación de la tráquea, distancia mayor de 6 mm entre una calcificación intimal y el contorno externo de la pared aórtica, ensanchamiento mediastínico, ensanchamiento de la aorta ascendente o descendente y ensanchamiento de la línea paraespinal. La separación entre la calcificación intimal y el contorno externo aórtico, signo muy referido en la literatura, es muy poco específico.
Datos de laboratorio
Los datos de laboratorio son muy inespecíficos. Es frecuente la leucocitosis y puede haber anemia por secuestro de sangre en la falsa luz o por extravasación de sangre desde la aorta. La creatinina puede aumentar cuando disminuye la perfusión renal. La hemólisis de sangre en la falsa luz provoca un aumento de la lactodeshidrogenasa en algunos pacientes 4. Recientemente se ha demostrado una muy alta precisión diagnóstica de la detección de determinados anticuerpos antimiosina para el diagnóstico de disección de aorta 5, aunque es un método todavía no disponible.
Ecocardiografía
El diagnóstico ecocardiográfico se basa en la detección del colgajo (flap) intimomedial que divide la aorta en dos luces, la verdadera y la falsa. La ecocardiografía transtorácica ofrece una sensibilidad entre el 50 y el 80% y una especificidad entre el 70 y el 90% 6,7. El estudio debe incluir la visualización de la aorta a través no sólo de las ventanas habituales (paraesternal izquierda y apical), sino también de las proyecciones supraesternal, supraclavicular, subcostal, abdominal y, si hay derrame pleural, subescapular. De esta manera se reconoce la aorta en toda su extensión. A pesar de ello, la visualización de la aorta descendente es especialmente dificultosa 8.
La ecocardiografía transesofágica (ETE)ha cambiado radicalmente la actitud diagnóstica en la disección de la aorta. El esófago está en íntimo contacto con la aorta, por lo que su estudio es muy completo. La gran limitación es la dificultad para estudiar la porción más alta de la aorta ascendente por la interposición de la tráquea y el bronquio principal izquierdo, aunque es muy raro que una disección se localice exclusivamente en esa región. Es fundamental una adecuada sedación del paciente para evitar bruscas subidas de la tensión arterial que puedan precipitar una rotura aórtica. La sensibilidad, la especificidad y los valores predictivos están por encima del 95% 9. El estudio transesofágico debe incluir los siguientes aspectos: identificación del colgajo, la luz verdadera y la luz falsa; identificación de la puerta de entrada; trombosis de la luz falsa; afectación de la aorta ascendente, cayado y aorta descendente; diámetro de la aorta; valoración de la válvula aórtica; afectación de las ramas aórticas incluyendo la porción proximal de las arterias coronarias y los troncos supraaórticos; estudio de la función ventricular, y presencia de derrame pericárdico. En todos estos aspectos, la ETE ha demostrado una alto rendimiento, por lo que si está disponible podría ser la técnica de elección. Además es rápida y puede hacerse sin necesidad de trasladar al paciente (tabla 1).
Tomografía computarizada
Los resultados ofrecidos por la tomografía computarizada (TC) son superponibles a los de la ETE. Su sensibilidad y especificidad están cerca del 100% 10. Tiene algunas limitaciones con respecto a otras técnicas, como la necesidad de utilizar contraste nefrotóxico, la limitada capacidad para detectar la puerta de entrada 10 y la falta de información hemodinámica referente sobre todo al estado de la válvula aórtica. Frente a esto, la TC está ampliamente disponible y es mucho menos dependiente del operador que el resto de técnicas. En los centros en los que no se disponga de ETE ni resonancia magnética (RM), la combinación de la ecocardiografía transtorácica y TC aporta una información diagnóstica exacta y rápida 11. Es, sin duda, suficiente para decidir el traslado urgente del paciente a un centro de referencia con cirugía cardiovascular o descartar el diagnóstico de disección de aorta.
Resonancia magnética
La RM puede considerarse la técnica más completa en el diagnóstico de la disección de la aorta, pues permite una evaluación exhaustiva de la morfología aórtica y de las estructuras que la rodean 12. Todas las características de la disección estudiadas por otras técnicas pueden ser también adecuadamente valoradas con la RM. La técnica de cine-RM puede identificar también la regurgitación aórtica al demostrar áreas de flujo turbulento en el ventrículo izquierdo durante la diástole 13. Sus grandes limitaciones son la escasa disponibilidad, la necesidad de más tiempo para su realización que otras técnicas y la dificultad para hacer la prueba en pacientes inestables e intubados. Además, está contraindicada en pacientes con marcapasos y con desfibrilador automático implantable.
Angiografía
El uso de la angiografía como herramienta diagnóstica en la disección aórtica se remonta a 1960; va a cumplir, pues, 40 años. Tiene una sensibilidad del 88%, una especificidad del 94% y una precisión diagnóstica para la disección aórtica del 98%.
La inyección de contraste yodado a gran velocidad en la aorta permite el estudio de su luz, de sus ramas, incluidas las coronarias, así como la evaluación de la válvula aórtica y su competencia.
El diagnóstico angiográfico de la disección aórtica se basa en la demostración de anomalías anatómicas.
Los signos directos son: a) presencia de «colgajo» (flap) íntimo-medial, visualizado como defecto de repleción intraluminal lineal y móvil; b) visualización de una luz falsa, con relleno de menor densidad que la verdadera y con lento lavado del contraste, y c) deformidad del borde y curvaturas normales de la aorta, por la compresión que ejerce el falso canal.
Los signos indirectos son: a) rigidez, falta de movilidad de un segmento de la pared aórtica, que puede expresar la presencia de hematoma, y b) aumento del grosor de la pared aórtica por encima de 5 mm.
Esta técnica puede fallar fundamentalmente por las siguientes causas: a) cuando el relleno del falso canal es muy bueno y la densidad del contraste es igual a la del verdadero, o cuando es muy malo y prácticamente no hay paso de contraste; b) cuando la disección es muy pequeña, y c) cuando con la angiografía «se ve» la luz de la aorta, pero «no se ve» la pared, como sucede en las imágenes ecográficas.
En resumen, la angiografía es una técnica con un buen rendimiento diagnóstico para la disección aórtica, segura, bien tolerada incluso en pacientes en situación crítica, y que tiene la ventaja de poder visualizar el estado de las ramas aórticas, incluidas las coronarias.
Seguimiento de los pacientes con disección de aorta
La evolución a medio-largo plazo de los pacientes con disección aórtica depende de las complicaciones residuales de la fase aguda y del correcto control de la presión arterial durante el seguimiento. La supervivencia a los 5 años de los pacientes dados de alta del hospital es del 75-82% 14. Las complicaciones tardías más frecuentes incluyen la disección recurrente, la dilatación aórtica y la rotura. En el 20% de las disecciones operadas aparece un aneurisma en otra región de la aorta en los primeros 2 años de seguimiento. Hasta un 30% de las muertes tardías después del tratamiento quirúrgico de la disección se producen por rotura de la disección o de un aneurisma remoto.
A parte de un correcto control de la presión arterial, el seguimiento de estos pacientes debe incluir la valoración, semestral o anual, de la aorta mediante técnicas de imagen. Antes del alta hospitalaria, es fundamental tener una correcta información de la extensión de la disección, la localización de la puerta de entrada, trombosis de la falsa luz, diámetro máximo de la aorta, severidad de la insuficiencia aórtica residual y afectación de troncos arteriales principales. La comparación de la medida de los diámetros entre diferentes técnicas de imagen demuestra una excesiva variabilidad (± 12 mm) 15, por lo que si se quiere valorar la dilatación progresiva de la aorta debería utilizarse siempre la misma técnica de imagen. La TC, la ETE y la RM permiten realizar un correcto seguimiento de la patología aórtica. No obstante, es importante considerar no sólo las ventajas de cada técnica, sino la experiencia y disponibilidad de las mismas en cada centro.
Disección tipo A
Cuando no se utiliza ecocardiografía intraoperatoria, la valoración de los resultados del tratamiento quirúrgico debe realizarse en el postoperatorio inmediato. En este contexto, la técnica de elección es la ETE dado que se puede practicar en la misma unidad de vigilancia intensiva. Las principales complicaciones que deben valorarse son la formación de un seudoaneurisma entre la pared de la aorta y el injerto vascular, la presencia de regurgitación aórtica significativa y la persistencia de disección de la aorta descendente. Los seudoaneurismas pueden encontrarse en el 10-25% de las disecciones de aorta ascendente en las que se ha implantado un tubo de dacron 16. Ocasionalmente, puede demostrarse una compresión externa del injerto secundaria a un hematoma periaórtico. Finalmente, en el 60-75% de los pacientes intervenidos por disección de la aorta ascendente persiste la disección distal al segmento operado 17,18.
El seguimiento a medio plazo de las disecciones de aorta ascendente a las que se les ha implantado un injerto con o sin reimplantación de coronarias debe realizarse mediante ETE o RM. Ambas técnicas son muy precisas en el diagnóstico de las complicaciones en la aorta ascendente proximal. Dado que en el 15-20% de los pacientes se produce una dilatación progresiva de la aorta (> 60 mm) en zonas distales a la intervención 19 a los 3 años de seguimiento, es importante valorar el arco y la aorta descendente. Probablemente, si no se puede realizar RM, debería alternarse anualmente la práctica de una ETE y TC para obtener una información completa de la aorta torácica y abdominal.
Disección tipo B
Los estudios clínicos que han realizado un seguimiento de la disección aórtica tipo B demuestran que el riesgo de rotura aórtica a los 5 años puede llegar a ser del 12-15% 14,20. El mayor riesgo lo tienen los pacientes con una hipertensión arterial no controlada o cuando la aorta excede 60 mm en diámetro 20. El 25-40% de las pacientes con disección aórtica tipo B requieren tratamiento quirúrgico por progresiva dilatación de la aorta 21. La presencia de un diámetro superior a 40 mm en la fase aguda y una puerta de entrada abierta en la aorta torácica son factores predictores de una progresiva dilatación de la aorta 21,22. Los pacientes con estos dos factores presentan una expansión de 0,8 mm/año y los que no tienen estos factores de sólo 0,2 mm/año 21. No hay estudios de seguimiento que permitan predecir el riesgo de rotura de los aneurismas de aorta torácica. Sin embargo, a partir de los aneurismas de aorta abdominal se considera que el riesgo de rotura puede llegar a ser superior al 20% anual cuando el diámetro supera los 60 mm e inferior al 4% cuando el diámetro es inferior a 50 mm 18. Un subgrupo especial son los pacientes afectados de síndrome de Marfan; en estos pacientes son frecuentes nuevas disecciones en diferentes segmentos de la aorta durante el seguimiento.
Pocos estudios han comparado la utilidad de las técnicas de imagen en el seguimiento de la disección de la aorta descendente 15. La ETE es especialmente sensible en la identificación de factores pronósticos como la puerta de entrada, el flujo y la presencia de trombosis en la falsa luz. Los pacientes con puerta de comunicación amplia entre ambas luces tienen un mayor riesgo de precisar cirugía durante el seguimiento debido al mayor estrés de pared. Los pacientes sin puerta de comunicación ni flujo en la falsa luz tienen un mejor pronóstico. Por otra parte, la trombosis parcial o total de la falsa luz es un signo de buen pronóstico 22,23.
La TC es la técnica diagnóstica más utilizada en el seguimiento de la disección de la aorta descendente. Aparte de su disponibilidad, tiene como principales ventajas que permite una valoración de toda la aorta, desde la válvula aórtica hasta el principio de las arterias ilíacas; es más reproducible que la ETE en la medida de los diámetros aórticos, y mediante la tomografía ultrarrápida espiroidal puede definirse la afectación de los troncos arteriales principales.
Finalmente, la RM es superior a las otras técnicas de imagen dado que proporciona una información muy exacta en los tres planos de estudio. Es especialmente útil en la valoración del tercio superior de la aorta ascendente, el arco y la afectación de los troncos supraaórticos. Por otra parte, permite una excelente valoración de los diámetros de la aorta, de los flujos de la verdadera y falsa luz, de la formación de trombos y de la patología periaórtica.
Los pacientes deben ser seguidos clínicamente y por técnicas de imagen a los 3 y 6 meses después de la disección aguda; a partir de entonces, cada 6 meses durante dos años y después a intervalos de 6 o 12 meses según el perfil de riesgo del paciente.
Hematoma intramural
El hematoma intramural aórtico plantea un seguimiento parecido al de la disección aórtica. No obstante, como este tipo de patología tiene un curso evolutivo mucho más dinámico que la disección, es aconsejable realizar un primer control en los tres primeros meses de seguimiento. En este intervalo de tiempo, no es excepcional evidenciar que el hematoma ha evolucionado a disección o, por el contrario, se ha reabsorbido totalmente. La RM es la técnica de elección en el seguimiento de los hematomas intramurales dado que permite valorar la presencia de resangrado activo durante el seguimiento 23,24.
Tratamiento médico de la disección aórtica
De nuevo es obligado hacer hincapié en la importancia del alto índice de sospecha, esto es, pensar en esta entidad para establecer el diagnóstico correcto de disección aórtica.
Una vez sospechada esta enfermedad, y durante la espera para la realización de los estudios diagnósticos oportunos, el paciente debe ser ingresado en la UVI, donde se monitorizará la presión arterial, la frecuencia cardíaca, la presión venosa central, el volumen de orina e incluso la presión capilar pulmonar. Se hará un tratamiento cuidadoso del dolor y de la hipertensión arterial.
El dolor está presente en el 90% de los pacientes y suele ser inaguantable. La morfina es un buen fármaco por su efecto hipotensor, pero pueden emplearse otros analgésicos.
La hipertensión arterial es un hallazgo también muy frecuente, sobre todo en las disecciones de la aorta abdominal. Cuando se registre hipotensión habrá que pensar en: a) taponamiento cardíaco; b) rotura de la aorta a la pleura o al peritoneo, y c) «seudohipotensión» debida a disección de los troncos braquiocefálicos.
El tratamiento para la hipertensión más recomendado, en esta entidad, son los vasodilatadores de acción rápida, concretamente el nitroprusiato. Para intentar evitar la progresión de la disección, así como la rotura de la aorta, además del control de la cifras de presión arterial, reduciendo la sistólica a 100-120 mmHg, se ha propuesto disminuir la velocidad y la fuerza de eyección del ventrículo izquierdo, con tratamiento betabloqueante. La pauta más clásica es 1 mg de propranolol i.v. cada 5 min hasta conseguir una frecuencia cardíaca de 60-70 latidos por minuto. Naturalmente, pueden ser empleados otros betabloqueantes con menos efectos secundarios. Los antagonistas del calcio, especialmente el nifedipino sublingual, son así mismo recomendables para el control de la HTA. Los IECA son útiles en la HTA refractaria debida a oclusión de la arteria renal.
En resumen, el tratamiento médico de la disección de la aorta tiene como objetivos controlar el dolor, la hipertensión arterial y disminuir la velocidad y fuerza eyectiva del ventrículo izquierdo. Todo ello va dirigido a dar bienestar al paciente y a evitar la progresión de la disección (tabla 2).
Una vez controlados el dolor, la hipertensión y disminuida la velocidad de contracción del ventrículo izquierdo, la elección terapéutica futura es distinta según la localización anatómica de la disección.
El tratamiento más extendido de la disección aórtica distal es, asimismo, médico, con una supervivencia hospitalaria del 80%. Esta localización sucede en pacientes de mayor edad, con enfermedad arteriosclerótica más avanzada y con frecuencia también con enfermedad cardiopulmonar sobreañadida. Todos estos factores sitúan a este tipo de pacientes en un riesgo quirúrgico elevado. Naturalmente, esta recomendación terapéutica no es universal y hay grupos que defienden el tratamiento quirúrgico. Sin embargo, hay estudios que demuestran iguales resultados con el tratamiento médico y quirúrgico en la disección aórtica no complicada distal. En una comunicación reciente se reseña mayor mortalidad en el grupo de pacientes con disección tipo B tratados con cirugía, frente a los tratados médicamente 25.
Nuevas opciones del tratamiento invasivo
La inserción percutánea a través de la arteria femoral de prótesis intraluminales, fundamentalmente metálicas (stents), para el tratamiento de la disección de aorta tipo B es ya una realidad.
Todavía se están llevando a cabo estudios experimentales 26,27, pero ya hay publicaciones que avalan la utilización de prótesis metálicas en la disección aórtica tipo B iatrogénica tras el empleo del balón de contrapulsación 28. También se ha descrito la implantación percutánea de stents recubiertos de teflón para el tratamiento de esta entidad 29.
En el Congreso del American College de 1999 hay una comunicación en la que se compara el tratamiento quirúrgico de la disección aórtica distal frente a la implantación endovascular percutánea de un stent recubierto; los resultados son mejores para el grupo tratado con stent, con nula morbimortalidad. Además, en el seguimiento con ETE y RM se visualiza remodelado de la aorta 30.
Es éste un campo que se esta abriendo. Probablemente, dentro de poco tiempo, sea tan común poner stents en la disección aórtica como lo es ahora en la disección coronaria.
Tratamiento quirúrgico de los aneurismas y disección de aorta(tablas 2 y 3)
A pesar de que las primeras descripciones clínicas de aneurismas aórticos datan del siglo XVI (Vesalio, 1557), la corrección quirúrgica en sus diferentes localizaciones no se inició hasta la segunda mitad del siglo XX 31, y sus hitos iniciales son los siguientes:
- Lillehei, en 1956, realiza la primera corrección de un aneurisma perforado de los senos de Valsalva.
- Bahnson, en 1953, realiza la primera reparación de un aneurisma de aorta ascendente.
- Cooley y De Bakey, en 1956, realizan una extirpación de un aneurisma de aorta ascendente con inserción de un homoinjerto.
- Bentall y Bono, en 1968, describen su técnica de corrección radical en pacientes con anulectasia aórtica 32.
- De Bakey, en 1957, realiza la primera extirpación de un aneurisma de cayado aórtico con inserción de un homoinjerto con perfusión cerebral a través del tronco arterial braquiocefálico y de la subclavia izquierda 33.
- Griepp, en 1975, realiza su técnica de extirpación de aneurismas del cayado con hipotermia profunda y parada circulatoria 34.
-Alexander y Byron, en 1943, realizan la primera extirpación de un aneurisma de aorta torácica descendente en paciente con coartación de aorta y aneurisma poscoartación.
- Dubost, en 1951, realiza la primera extirpación de un aneurisma de aorta abdominal.
Aneurismas de los senos de Valsalva
1. Pacientes asintomáticos. En principio no tienen indicación quirúrgica. Se deben controlar médicamente viendo la evolución por métodos no invasivos.
2. Pacientes sintomáticos. Por arritmias, bloqueos, obstrucción al tracto de salida de VD o VI, perforación en una cavidad cardíaca o en el pericardio, etc. En casos de aparición brusca de sintomatología severa, tiene incluso indicación quirúrgica con carácter urgente.
3. En pacientes cuya etiología sea infecciosa (con o sin prótesis aórtica previa) o disección de aorta, debe hacerse, así mismo, una indicación quirúrgica con carácter de urgencia. Evidentemente también se deberá llevar a cabo tratamiento específico.
La mortalidad quirúrgica publicada en la actualidad oscila entre el 0 y el 15% y está directamente relacionada con la etiología, la edad de los pacientes y la asociación con otras lesiones cardíacas o factores de riesgo extracardíaco.
En los pacientes con etiología diferente de la endocarditis o disección, el pronóstico a largo plazo es muy bueno, habiéndose publicado supervivencias que superan el 90% a los 15 años.
Aneurismas de aorta ascendente
1. Por el tamaño. Cuando los aneurismas tienen un diámetro de 4-5 cm, se recomienda seguimiento periódico de tres a seis meses con control ecocardiográfico y observar su evolución. Se indica cirugía programada en diámetros mayores de 5 cm y se debe indicar cirugía con cierta urgencia cuando se superan los 6 cm de diámetro.
2. Por la clínica. En pacientes sintomáticos o con signos de valvulopatía aórtica severa de evolución progresiva en controles periódicos, debe indicarse la cirugía de forma programada. Cuando aparece dolor se debe operar de urgencia ante el riesgo de rotura o disección.
3. Etiología. Los aneurismas micóticos, con o sin cirugía cardíaca previa, deben ser intervenidos sin gran dilación, ante el riesgo de rotura o embolismo séptico. Las anulectasias aórticas deben ser operadas de forma programada, pero sin dejar pasar mucho tiempo por la gran tendencia que tienen a la disección o rotura.
El riesgo quirúrgico, siempre que la intervención se haga de forma programada, oscila entre el 5-10% y está relacionado directamente con el grado funcional, edad del paciente, factores de riesgo extracardíacos, etc.
El pronóstico a medio largo plazo es muy bueno con supervivencias cercanas al 90% a los 10 años.
Aneurismas del cayado aórtico
Sigue los mismos criterios que se citaban para los aneurismas de aorta ascendente, teniendo en cuenta que en los del cayado son más frecuentes los síntomas de compresión de estructuras vecinas.
La mortalidad quirúrgica se encuentra alrededor del 15% existiendo, además, un riesgo de complicaciones neurológicas de importancia en otro 10%.
Para los pacientes que superan el postoperatorio inmediato, el pronóstico a largo plazo es muy bueno, con supervivencias del 90% a los 10 años en la serie publicada por Crawford 32.
Aneurismas de aorta torácica descendente
Ante el riesgo de rotura o perforación en estructuras vecinas (esófago, bronquios) que presentan los aneurismas de esta localización, la indicación de cirugía programada debe establecerse en el momento en que se hace el diagnóstico. En aquellos pacientes con dolor, hemoptisis o hematemesis, la intervención debe realizarse de urgencia, ya que estos síntomas pueden indicar rotura o perforación del aneurisma.
En los casos que se asocian con cardiopatía isquémica se debe realizar en primer lugar la revascularización miocárdica y posteriormente la aneurismectomía, salvo en los pacientes con indicación quirúrgica urgente, a fin de evitar los riesgos de IAM peroperatorio (tabla 3).
La mortalidad quirúrgica es inferior al 10% y se relaciona fundamentalmente con la aparición de un infarto peroperatorio. De ahí la necesidad de realizar siempre coronariografía previa a estos enfermos. Las complicaciones postoperatorias más frecuentes son las neurológicas y renales. La incidencia de paraplejía se mantiene en el 5-10% sin que aún se haya determinado definitivamente cuál de los sistemas empleados preserva mejor la médula para evitar la aparición de esta grave complicación. Lo único que parece seguro es que el tiempo de clampaje inferior a los 30 min disminuye de forma considerable el riesgo de esta complicación. Así mismo, la aparición de lesiones de los nervios vago, recurrente y frénico debe tenerse en cuenta a fin de evitarlas en las maniobras de disección. La insuficiencia renal postoperatoria complica de forma importante el postoperatorio inmediato e, incluso, puede ser causa de mortalidad per se.
A largo plazo el resultado es bueno, con supervivencias próximas al 70% a los diez años.
Aneurismas de aorta abdominal
1. Por el tamaño. En principio, aquellos aneurismas con un diámetro inferior a 5 cm deben seguirse médicamente cada 6 meses para valorar su evolución, dado el bajo riesgo de rotura que presentan. Por encima de 5 cm de diámetro se debe indicar la cirugía de forma programada y cuando sobrepasan los 7 cm se debe indicar la cirugía con carácter semiurgente por el alto riesgo de rotura.
2. Por la clínica. Debe indicarse cirugía en todos aquellos pacientes sintomáticos. Cuando aparece dolor o cualquier otro síntoma o signo sugerente de rotura, la intervención se indicará con carácter urgente. Cuando la rotura se ha producido, la cirugía se realizará con extrema urgencia si se quiere salvar la vida del paciente.
3. Por los factores de riesgo. Se han descrito una serie de patologías asociadas a la existencia de aneurismas aórticos y que aumentan de manera importante el riesgo de rotura de los aneurismas. En este sentido, se puede citar la hipertensión arterial, EPOC, cirugía previa, etc., que indicarían la cirugía aunque el paciente esté asintomático o su diámetro sea menor de 5 cm.
La mortalidad quirúrgica global, en pacientes bien seleccionados, es inferior al 5%, aunque con la técnica endovascular se ha referido un 1,5%, y se debe fundamentalmente a un infarto de miocardio peroperatorio.
La supervivencia a largo plazo es buena, con una media del 70% a los cinco años, aunque en pacientes sin cardiopatía isquémica es del 85% y en aquellos con cardiopatía isquémica previa sólo es del 55%. Así mismo, se ha descrito una tasa de reoperaciones de un 1-2% por aparición de nuevos anuerismas o seudoaneurismas en las suturas.
Aneurismas toracoabdominales
Participan de las características generales de los aneurismas de aorta torácica descendente y la aorta abdominal.
Las indicaciones se corresponden a las descritas previamente pero, dada la importancia de la intervención y el riesgo quirúrgico, se han de valorar más exhaustivamente las contraindicaciones y los factores de riesgo cardíaco o extracardíaco para poder obtener resultados asumibles. En este sentido es muy importante la detección de la cardiopatía isquémica y su tratamiento quirúrgico previo, para disminuir en lo posible el riesgo de infarto peroperatorio, que representa la mayor causa de mortalidad. Igualmente, se valorarán y tratarán la hipertensión arterial, insuficiencia renal, insuficiencia respiratoria, etc., que pueden llegar a contraindicar de forma absoluta la cirugía.
La mortalidad es discretamente superior a la de los apartados anteriores, así como la incidencia de paraplejía, a pesar de los sistemas de control neurológico o las derivaciones utilizadas (circulación extracorpórea izquierda parcial, shunt de Gott, etc.).
El pronóstico a medio plazo, aunque no existen muchas series amplias publicadas, parece seguir una evolución paralela a la de los aneurismas abdominales, con una mayor incidencia de complicaciones viscerales.
Aneurismas traumáticos de aorta
Constituyen un grupo extremadamente raro de aneurismas aórticos. Dado que la mortalidad de la rotura traumática de la aorta es de un 80% antes de la llegada al hospital y que sólo en el 2% la rotura queda contenida por la adventicia aórtica, dando lugar a la formación de un seudoaneurisma, la posibilidad de un diagnóstico preciso y rápido de la existencia de esta lesión y su tratamiento quirúrgico urgente puede evitar la muerte inexorable de un buen número de pacientes.
La mortalidad operatoria se encuentra en torno al 10% y sus causas están relacionadas con otras lesiones sufridas en el mismo traumatismo. Las posibles complicaciones postoperatorias son similares a las descritas en los aneurismas de aorta descendente, así como el pronóstico a largo plazo, evidentemente todo ello condicionado a la evolución de las demás lesiones presentes en el traumatismo.
Sea cual sea el tipo de aneurisma, su etiología, localización y tratamiento quirúrgico empleado, todos los enfermos deben seguir controles periódicos ante la posibilidad de recidivas en las suturas o aparición de nuevos aneurismas.
Disección de aorta
-Sounertum, en 1542, describió por primera vez una disección de aorta.
-Morgani, en 1761, describe la evolución clínica y los hallazgos anatomopatológicos.
-Gurin, en 1935, realiza el primer intento de tratamiento quirúrgico de una disección mediante una fenestración de la arteria ilíaca.
- De Bakey, Cooley y Creech, en 1955, publican los primeros tratamientos transtorácicos de una disección de aorta 33.
Las disecciones tipo A de Stanford o tipos I y II de De Bakey tienen indicación quirúrgica urgente ante la posibilidad de rotura o progresión de la disección con la consiguiente aparición de complicaciones irreversibles.
Las disecciones subagudas o crónicas tipo A deben ser intervenidas de forma programada con carácter semiurgente, por la posibilidad de rotura, progresión de la disección o afectación retrógrada de la válvula aórtica (tabla 2).
Las disecciones tipo B o tipo III deben ser tratadas médicamente, en lo que están de acuerdo la inmensa mayoría de los equipos médico-quirúrgicos. El tratamiento debe estar encaminado inicialmente a disminuir la fuerza contráctil del corazón y la presión arterial. La indicación quirúrgica se reserva para aquellos pacientes con fracaso del tratamiento médico con persistencia del dolor, signos de progresión de la disección, afectación del sistema nervioso central, insuficiencia renal, isquemia visceral, etc. (tabla 2).
Como en toda cirugía de alto riesgo, es muy importante la valoración de las contraindicaciones, tanto las generales de toda la cirugía cardíaca como las específicas de esta patología, como la afectación neurológica severa (hemiplejía o paraplejía preoperatorias), fracaso renal agudo, isquemia mesentérica establecida, etc.
La mortalidad operatoria global ha ido disminuyendo en los últimos años hasta alcanzar una cifra global del 20-25%, y es mucho mayor en los casos de disección aguda que en las formas crónicas.
Aun así, se publican cifras de mortalidad muy dispares en la actualidad, que oscilan entre el 14-31% para el tipo I, el 8-20% para el tipo II y el 25-62% para el tipo III.
Las causas más frecuentes de mortalidad son la rotura aórtica, hemorragia, infarto de miocardio, afección neurológica, bajo gasto, insuficiencia renal, insuficiencia pulmonar o infección. El riesgo de hemorragia quirúrgica ha disminuido sensiblemente con el uso de aprotinina y de cola biológica.
Alrededor del 30% precisan reoperación por hemorragia, hemotórax, seudoaneurismas o progresión de la disección, ya que en muchos pacientes persiste la falsa luz debido a los múltiples desgarros de la íntima. El cierre del desgarro en la aorta ascendente no impide en todos los casos la progresión de la falsa luz al no trombosarse la misma. Esto es más frecuente en la disección tipo III anterógrada comunicante y en la tipo III retrógrada que se extiende hasta aorta ascendente.
La supervivencia a corto plazo oscila entre el 50 y el 70%, dependiendo de los tipos, siendo el más favorable el tipo II y el menos el tipo I con comunicación y extensión anterógrada.
La incidencia de complicaciones tardías que precisan reoperación permanece constante y es la causa de mortalidad tardía.
A pesar de todos los avances de los últimos años, el pronóstico a largo plazo sigue siendo malo. Por todo ello, estos pacientes precisan revisiones periódicas frecuentes, a fin de detectar lo antes posible la aparición de complicaciones.
Hematoma intramural aórtico
Esta patología de difícil ubicación es considerada como una forma atípica de disección aórtica.
La evolución depende en gran manera de su localización, de forma que los localizados en la aorta ascendente tienen tendencia a la progresión e incluso a la disección, mientras que en aorta descendente permanecen estables y localizados en su mayoría. Aunque todos los equipos no están de acuerdo, esta diferencia evolutiva va a marcar la posibilidad de indicación quirúrgica, de forma que la cirugía estará indicada de inicio en los procesos localizados en la aorta ascendente, mientras que se hará un seguimiento médico en los localizados en aorta descendente, quedando la decisión a expensas de la evolución.
La técnica quirúrgica consiste en la resección de la zona afectada y su sustitución por un injerto, como ya se ha descrito anteriormente.
El riesgo quirúrgico es inferior al 5% y la posibilidad de complicaciones está directamente relacionada con la etiología, la localización y la extensión.
Aunque no hay estudios suficientemente amplios, el pronóstico a medio plazo parece ser bueno, aunque es preciso realizar revisiones periódicas ante la posibilidad de recidivas.
Fuente:
Sociedad Española de Cardiología
Revista Española de Cardiología
Bibliografía
1. Eagle KA, Quertermous T, Kritzer GA, Newell JB, Dinsmore R, Feldman L et al. Spectrum of conditions initially suggesting acute aortic dissection but with negative aortograms. Am J Cardiol 1986;57: 322-326.
Medline
2. Jagannath AS, Sos TA, Lockhart SH, Saddekni S, Sniderman KW. Aortic dissection: a statistical analysis of the usefulness of plain chest radiographic findings. Am J Radiol 1986;147: 1123-1126.
3. Luker GD, Glazer HS, Eagar G, Gutiérrez FR, Sagel SS. Aortic dissection: effect of prospective chest radiographic diagnosis on delay to definitive diagnosis. Radiology 1994;193: 813-819.
Medline
4. Slater AA, De Sanctis RW. The clinical recognition of dissecting aortic aneurysm. Am J Med 1976;60: 625-633.
Medline
5. Suzuki T, Katoh H, Watanabe M, Kurabayashi M, Hiramori K, Hori S et al. Novel biochemical diagnostic method for aortic dissection. Results of a prospective study using an immunoassay of smooth muscle myosin heavy chain. Circulation 1996;93: 1244-1249.
Medline
6. Kasper W, Meinertz T, Kersting F, Lang K, Just H. Diagnosis of dissecting aortic aneurysm with suprasternal echocardiography. Am J Cardiol 1978;42: 291-294.
Medline
7. Victor MF, Mintz GS, Kotler MN, Wilson AR, Segal BL. Two-dimensional echocardiographic diagnosis of aortic dissection. Am J Cardiol 1981;48: 1155-1159.
Medline
8. Mathew T, Nanda NC. Two-dimensional and Doppler echocardiographic evaluation of aortic aneurysm and dissection. Am J Cardiol 1984;54: 379-385.
Medline
9. San Román JA, Vilacosta I, Fernández Avilés F. Disección de aorta: evaluación clínica, comparación de las técnicas diagnósticas y elección del tratamiento. Rev Esp Cardiol 1996;49 (Supl 4): 2-12.
10. Vasile N, Mathieu D, Keita K, Lellouche D, Bloch G, Cachera JP. Computed tomography of thoracic aortic dissection: accuracy and pitfalls. J Comput Assist Tomogr 1986;10: 211-215.
Medline
11. Tottle AJ, Wilde RP.H, Hartnell GG, Wisheart JD. Diagnosis of acute thoracic aortic dissection using combined echocardiography and computed tomography. Clin Radiol 1992;45: 104-108.
Medline
12. Panting JR, Norell MS, Baker C, Nicholson AA. Feasibility, accuracy and safety of magnetic resonance imaging in acute aortic dissection. Clin Radiol 1995;50: 455-458.
Medline
13. Sechtem U, Pflugfelder PW, Cassidy MM, White RD, Cheitlin MD, Schiller NB et al. Mitral or aortic regurgitation: quantification of regurgitant volumes with cine MR imaging. Radiology 1988;167: 425-430.
Medline
14. Doroghazi RM, Slater EE, DeSanctis RW, Buckley MJ, Austen WG, Rosenthal S. Long-term survival of patients with treated aortic dissection. J Am Coll Cardiol 1984;3: 1026-1034.
Medline
15. Masani ND, Banning AP, Jones RA, Ruttley MS, Frase AG. Follow-up of chronic thoracic aortic dissection: comparison of transesophageal echocardiography and magentic resonance imaging. Am Heart J 1996;131: 1156-1163.
Medline
16. Barbetseas J, Crawford S, Safi HJ, Coselli JS, Quinones MA, Zoghbi WA. Doppler echocardiographic evaluation of pseudoaneurysms complicating composite grafts of the ascending aorta. Circulation 1992;85: 212-222.
Medline
17. Simon P, Owen AN, Kupilik N, Moidl R, Kupilik N, Grabenwoeger M, Anwari A et al. Transoesophageal echocardiographic follow-up of patients with surgically treated aortic aneurysms. Eur Heart J 1995;16: 402-405.
Medline
18. Moore NR, Parry AJ, Trottman-Dickenson B, Pillai R, Westaby S. Fate of the native aorta after repair of acute type A dissection. A magnetic resonance imaging study. Heart 1996;75: 62-66.
Medline
19. Heinemann M, Laas J, Karck M, Borst HG. Thoracic aortic aneurysms after acute type A aortic dissection: necessity for follow-up. Ann Thorac Surg 1990;49: 580-584.
Medline
20. Neya K, Omoto R, Kyo S, Kimura S, Yokote Y, Takamoto S et al. Outcome of Stanford type B acute aortic dissection. Circulation 1992;86: 1-7.
Medline
21. Kato M, Bai H-Z, Sato K, Kawamoto S, Kaneko M, Ueda T et al. Determining surgical indications for acute type B dissection based on enlargement of aortic diameter during the chronic phase. Circulation 1995;92 (Supl 9): II107-112.
22. Erbel R, Oelert H, Meyer J, Puth M, Mohr-Katohy S, Hausman D et al. Effect of medical and surgical therapy on aortic dissection evaluated by transesophageal echocardiography. Circulation 1993;87: 1604-1615.
Medline
23. Mohr-Kahaly S, Erbel R, Rennollrt H, Wittkich N, Drexler M, Oelert H et al. Ambulatory foloow-up of aortic dissection by transesophageal two-dimensional and color-coded Doppler echocardiography. Circulation 1989;80: 24-33.
Medline
24. Mohr-Kahaly S, Erbel R, Kearney P, Puth M, Meyer J. Aortic intramural hemorrhage visualised by transesophageal echocardiography: findings and prognostic implications. J Am Coll Cardiol 1994;23: 658-664.
Medline
25. Hagan PG, Nienaber CA, Das S. Acute aortic dissection: modern clinical spectrum. Results from the International Registry for Aortic Dissection. J Am Coll Cardiol 1999;32 (Supl A): 224.
26. Marty-Ané Ch, Serre-Cousiné O, Laborde JC.l, Costes V, Alauzen M, Mary H et al. Use of endovascular stents for acute aortic dissection: an experimental study. Ann Vasc Surg 1994;8: 434-442.
Medline
27. Marty-Ané Ch, Serre-Cousiné O, Laborde JC.l, Costes V, Alauzen M, Mary H et al. Use of balloon-expandable intravascular graf in the management of type B aortic dissection in an animal model. J Vasc Intervent Radiol 1995;6: 97-103.
28. Johnson MS, Lalka SG. Successful treatment of an iatrogenic infrarenal aortic dissection with serial Wallstents. Ann Vasc Surg 1997;11: 295-299.
Medline
29. Seo Y, Kaneko M, Kato M, Kurutani T, Mizushima T. Transcatheter stent-graft implantation for the treatment of acute aortic dissection. Jpn J Thorac Cardiovasc Surg 1998;46: 179-184.
Medline
30. Nienaber CA, Fattori R, Lund G, Dieckmann C, Wolf W, Von Kodolistsch Y et al. Nonsurgical reconstruction of thoracic aortic dissection. J Am Coll Cardiol 1999;33 (Supl A): 310.
31. Erbel R, Zamorano J. The aorta. Aortic aneurysm, trauma and dissection. Crit Care Clin 1996;12: 733-766.
Medline
32. Bentall H, Bono A. A technique for complete replacement of the ascending aorta. Thorax 1968;23: 338.
Medline
33. De Bakey ME, McCollum CH, Crawford ES, Morris GC Jr, Howell J, Noon GP et al. Dissection and dissecting aneuryms of the aorta: twenty-year follow-up of five hundred twenty seven patients treated surgically. Surgery 1982;92: 1118.
Medline
34. Griepp RB, Stinson EB, Hollingsworth JF, Buehlev D. Prosthetic replacement of the aortic arch. J Thorac Cardiovasc Surg 1975;70: 1091.
![]()
Genntileza:Dr. Jimmy Anzueta