Autor:
Carlos Federico Carriquiry
Ex Residente de Nefrología, HIGA San Martín, La Plata, Bs. As., Argentina
Director de Monografía: Dr. Luis Maximiliano Malinar, Instructor de Residentes, Residencia de Nefrología, HIGA San Martín, La Plata
Índice General
Introducción………………………………………………………………………….3
Caso clínico………………………………………………………………………….4
Definición y epidemiología………………………………………………………....5
Etiología…………………………........................................................................8
Evaluación……………………….......................................................................11
Rol de la biopsia renal…………………………….……………….……………….18
Hematuria microscópica glomerular: Historia natural y pronóstico…..………..22
Conclusiones………………………………………………………………..……….25
Bibliografía……………………………………………………………………..…….27
INTRODUCCIÓN
La hematuria microscópica aislada, merced a su elevada prevalencia, constituye un frecuente motivo de consulta y derivación a consultorios de Urología y Nefrología. Sumándose a esta condición epidemiológica, este tópico se trata de un signo que potencialmente expresa una pléyade de posibilidades diagnósticas, desde afecciones triviales hasta procesos que implican un riesgo concreto y grave para la integridad del paciente. Más aún, la pesquisa de dichas entidades nosológicas implica necesariamente la aplicación de métodos de estudio complementarios, algunas veces complejos o invasivos, con los consiguientes costos y riesgos involucrados. Adicionalmente, luego de una evaluación exhaustiva, no es posible arribar a un diagnóstico en oportunidades para nada infrecuentes. Ergo, se genera la perspectiva de una afección no filiada, generando ansiedad y preocupación comprensibles tanto de parte del enfermo como del profesional.
Debido a todas estas cuestiones, amerita llevar a cabo un trabajo de revisión sobre hematuria microscópica aislada, aludiendo en particular, a los aspectos más controvertidos o discutidos respecto al estudio y manejo de esta condición.
Esta monografía iniciará con la narración de un caso clínico visto en el Consultorio Externo de Nefrología del HIGA San Martin de La Plata. Se trata de un paciente arquetípico, sin las grandes y ampulosas disquisiciones diagnóstico terapéuticas que caracterizan a patologías nefrológicas complejas, algunas de las cuales se han puesto en boga últimamente a expensas de temas “olvidados” como el que nos ocupa. Sin embargo, constituirá el puntapié inicial para considerar las distintas posibilidades diagnósticas, repasar el trabajo diagnóstico urológico a implementar, contrastándolo con las recomendaciones más actuales de las guías disponibles, y fundamentalmente, enfocar el tópico desde la perspectiva nefrológica. A este respecto, uno de los principales objetivos es dilucidar, a partir de la evidencia disponible, la cuestión relativa al pronóstico de esta condición, sobre todo, cuando luego de la evaluación no se llega a un diagnóstico preciso. Particularmente, el enfoque versará sobre la práctica de la biopsia renal y otros estudios invasivos, donde no existe un criterio unificado, sino posturas muy dispares entre los nefrólogos. Merced a esta consideración, intentaré interpretar la evidencia asequible desde la perspectiva del juicio clínico, evitando tanto el nihilismo diagnóstico terapéutico como la aplicación excesiva de procedimientos riesgosos.
CASO CLÍNICO
Paciente H.F. Femenina, de 47 años de edad, oriunda de La Plata. No tenía antecedentes familiares de relevancia. Como antecedentes personales refirió 3 gestas normales, con partos sin complicaciones (G3/P3/A0). Manifestó hábito tabáquico de 10 paquetes/año.
Consultó en febrero de 2017 por consultorio externo de nefrología, debido a detección de hematuria microscópica en sedimento urinario durante un examen prelaboral. Al interrogatorio se rescató el antecedente de tabaquismo, ya mencionado. Al examen físico no se halló ningún signo de relevancia. Se constató tensión arterial de 110/70 mmHg, frecuencia cardíaca de 72 latidos por minuto. Trajo consigo los resultados del examen que motivaron la consulta, donde se apreciaba: Hto 38%, GB 7600/mm3, urea 0,29 g/l; creatinina 0,79 mg%, Dipstick sangre positivo +.
Regresa en abril del mismo año, con los resultados de los estudios solicitados, a saber: sedimento urinario que confirma la hematuria microscópica, con la presencia de 10 hematíes por campo de gran aumento (CGA), analítica de sangre y orina de 24 horas que indica clearence de creatinina de 97 ml/min, proteinuria negativa, sin alteraciones en todos los parámetros hemáticos y de química clínica. Urocultivo negativo. Ecografía renal que informa riñones de tamaño, forma y ecorrespuesta conservados, sin urostasis, vejiga sin alteraciones. Continúa normotensa, sin hallazgos semiológicos relevantes.
En junio de ese año, completó una evaluación ginecológica que incluía ecografía pertinente y descartó patología. Se realizó un nuevo sedimento urinario que evidenció 5 hematíes/CGA, con 17% de dismorfia. Se realizó una tomografía computada de abdomen y pelvis con cortes finos para árbol urinario, sin y con contraste en fase parenquimatosa y excretora. Éste estudio resultó completamente normal, no se identificaron anomalías orgánicas, litiasis ni alteraciones vasculares. Se realizó una nueva evaluación de orina de 24 horas, indicando normoalbuminuria, e incluyendo esta vez un estudio metabólico que descartó hipercalciuria e hiperuricosuria. El clearence de creatinina continuaba mayor de 90 ml/min y la tensión arterial era normal.
En julio el urólogo que seguía conjuntamente con este servicio a la paciente decide llevar a cabo una cistoscopía, atendiendo a la edad y al hábito tabáquico de la paciente. El resultado de la misma fue normal.
DEFINICIÓN Y EPIDEMIOLOGÍA
Es relativamente común constatar la aparición de unos pocos glóbulos rojos en la orina de personas en algún momento a lo largo de su vida. En algunos casos, esta presencia de hematíes constituye el signo de presentación de alguna patología significativa renal o urológica.1
El médico que se encuentra ante esta eventualidad, se enfrenta a la decisión de iniciar una evaluación a fin de pesquisar la presencia de dichas enfermedades. Justamente, la implementación de una definición de hematuria microscópica (HM) determinaría la cantidad de glóbulos rojos (GR) a considerar como significativa, es decir, que expresaría la potencial presencia de una enfermedad subyacente y, por ende, la necesidad de emprender estudios adicionales. Además, debería tener un adecuado valor predictivo negativo, a fin de descartar con fidelidad dichas anomalías.
Cabe aclarar que independientemente de los valores o puntos de corte considerados a fin de lograr una definición operativa, una condición necesaria para definir HM asintomática o aislada, es corroborar la ausencia de deterioro de la función renal, proteinuria o hematuria macroscópica.
La definición de HM varía ampliamente según los estudios o guías consultadas. La mayoría toman distintos valores como punto de corte dentro del rango de 2 a 10 GR x CGA. La Asociación Urológica Americana (AUA) toma como parámetro la presencia de 3 o más GR x CGA en una muestra de orina de chorro medio centrifugada.2 Este punto de corte es el más utilizado en la bibliografía reciente.3 Las guías canadienses toman el mismo valor, pero aclarando la necesidad de positividad en al menos dos determinaciones realizadas, en ausencia de condiciones que podrían dar falsos positivos (menstruación, ejercicio vigoroso, coito o instrumentación urinaria). Asimismo, otros recomiendan considerar HM la positividad de al menos dos de tres sedimentos realizados en el lapso de 2 a 3 semanas. No obstante, la evidencia existente no sostiene una diferencia sustancial en la probabilidad de patología urinaria seria entre la HM persistente y la transitoria, sobre todo teniendo en cuenta que muchas entidades de esta clase se manifiestan por hematuria intermitente.2 Otro modo de definir HM es a partir de la positividad de la tira reactiva para hemoglobina (dipstick); en este caso la Asociación Británica Renal y de Cirujanos Urológicos considera HM, un dipstick con igual o mayor de 1+.
Algunos matices deben tenerse en cuenta respecto a los dos métodos de detección de hematuria. El dipstick acarrea cierta tasa de falsos positivos (especificidad 65 – 99%), por ejemplo ante mioglobinuria, hemoglobinuria, deshidratación. Sin embargo, es altamente sensible (únicamente se encuentra descripto el exceso de vitamina C como causa de falso negativo); y, aunque es un tema controversial, algunos autores no consideran necesario confirmarlo por microscopía del sedimento. Éste último, si bien se considera el patrón de oro, puede tener falsos negativos, particularmente ante orina muy diluida o ante la demora en el examen de la misma, ya que los GR se pueden lisar en estas condiciones. Por ejemplo, en un estudio, 2 de 35 pacientes con dipstick positivo, pero sedimento negativo tenían finalmente cáncer de vejiga.4 Sin embargo, la opinión mayoritaria sostiene que es necesario confirmar por sedimento un dipstick positivo. En otro estudio, sólo se confirmó 14 (25,9%) de 54 casos de HM en el sedimento luego de un dipstick positivo.5 De esta manera, emprender una evaluación a partir de únicamente un dipstick positivo expondría a los pacientes a costos y riesgos innecesarios en muchas ocasiones. La AUA sugiere, en estos casos, repetir tres sedimentos y si resultan todos negativos, se descarta la presencia de HM.
Cabe mencionar respecto a la metodología de examen de la orina, ciertos aspectos a tener en cuenta a fin de evitar resultados falsos. Se debe evaluar preferentemente la primera micción matutina, ya que al estar más concentrada y ácida, incrementa el rédito. El tiempo hasta el procedimiento no debe demorar más de una hora para el sedimento, o dos horas para el dipstick.
Otra cuestión importante en todos los casos, pero fundamentalmente ante la presencia de piuria o bacterias, es tomar cultivos de orina, instaurar tratamiento antibiótico adecuado y reevaluar la presencia de HM luego de seis semanas.
Respecto a la epidemiología, la variabilidad en las definiciones propuestas para HM dificulta la capacidad de brindar un cálculo exacto de su prevalencia. Se han reportado cifras entre 0,18% a 16,1% en población general.3 En exámenes periódicos de salud es esperable hallar aproximadamente un 2,5% de sedimentos con cantidad significativa de hematíes, pudiendo incluso llegar al 20% en ciertos subgrupos de pacientes (varones, mayores de 60 años, tabaquistas, mujeres postmenopáusicas con prolapso pelviano o atrofia vaginal).1 De todos modos, si se toma en cuenta el frecuente requerimiento de positividad en más de un examen de sedimento, la prevalencia es lógicamente menor. Por ejemplo, un estudio realizado en Israel que evaluó más de un millón de adolescentes y adultos jóvenes, encontró un 0,3% de HM persistente, definida como la presencia de al menos 5 GR x CGA en al menos 3 ocasiones.6
Una cuestión que ha sido debatida, es la vinculación de la HM asintomática con las terapias antiagregante y anticoagulante (aspirina y warfarínicos). La evidencia disponible señala que las tasas de HM entre usuarios y no usuarios de antiagregantes son las mismas y tampoco difiere la frecuencia de neoplasias del tracto urinario en dichos casos. Los agentes anticoagulantes tampoco parecen justificar la presencia de hematuria, excepto en casos de marcado exceso de anticoagulación. Ergo, la aparición de HM asintomática en estos pacientes debe ser enfocada de la misma manera que en la población general.
Para finalizar este capítulo, se considera la cuestión del cribado para HM en la población general asintomática (screening). Las principales guías urológicas no apoyan el screening universal en la búsqueda de patología, dado que la frecuencia de enfermedad maligna urológica en la población general es muy baja (0,01 – 3%) como para justificarlo. Sin embargo la realidad evidente es que anualmente millones de pacientes son sometidos al mismo, fundamentalmente mediante dipstick.
ETIOLOGÍA
La HM puede surgir a partir de cualquier localización en el tracto urinario, desde el glomérulo hasta el meato uretral. Por lo tanto constituye el signo de presentación de una miríada de enfermedades renales y urológicas. Dejando de lado causas fisiológicas, ya mencionadas previamente, como ser la actividad física intensa, menstruación, coito, etc., el espectro de patologías que expresan como común denominador HM es extremadamente amplio. Así, puede originarse a partir de condiciones relativamente banales como una cistitis infecciosa aguda hasta causas más temidas, que en última instancia ponen en peligro la vida del paciente, entre ellas tumores (cáncer de vejiga, hipernefroma) y glomerulopatías que pudieran derivar en enfermedad renal crónica severa.7 A continuación se detallan las posibles etiologías de HM asintomática (tabla 1).
Tabla 1. Orígenes anatómicos de la hematuria microscópica
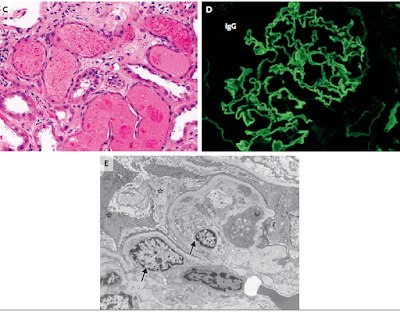
Respecto a la frecuencia de cada una de estas causas, predominan las no glomerulares. Sin embargo, como en la mayoría de los ámbitos, la biopsia renal no forma parte de la evaluación rutinaria de la HM asintomática, probablemente exista una subestimación del origen glomerular. Se ha sugerido que las causas nefrológicas representan aproximadamente el 10% de HM y también de hematuria macroscópica. En un estudio donde se llevó a cabo biopsia renal a todos los pacientes en quienes no se llegaba a un diagnóstico luego de la evaluación inicial, se corroboró el origen nefrológico en un 16%, con predominio de nefropatía IgA.8 De hecho, esta glomerulopatía es, de manera prácticamente unánime, la causa reportada más frecuente de HM asintomática. Otro motivo habitual de HM glomerular es la enfermedad de membrana basal fina, una condición hereditaria caracterizada por un adelgazamiento difuso de la membrana basal glomerular. Un estudio sobre biopsia renal en HM asintomática encontró que la enfermedad de membrana basal fina fue la causa más frecuente en pediatría (20-50%), mientras que en adultos queda relegada al segundo lugar, siendo la nefropatía IgA la glomerulopatía más habitual (28%).9 La tercera causa glomerular en frecuencia son las nefritis hereditarias, particularmente la enfermedad de Alport, trastorno hereditario del gen del colágeno tipo IV (generalmente ligado al cromosoma X), que provoca alteraciones de la membrana basal glomerular, con el posterior desarrollo de proteinuria, deterioro del filtrado glomerular y eventual enfermedad renal crónica estadío V. Además suele asociar alteraciones corneales (lenticono) y sordera neurosensorial. Más raramente pueden encontrarse otras glomerulopatías (proliferativas focales leves, nefropatía membranosa, glomeruloesclerosis focal y segmentaria, etc). Además, una proporción elevada de biopsias renales arroja un resultado normal, reportándose glomérulos sin alteraciones en 17 – 62% de los casos. Conviene tener en cuenta que las frecuencias más elevadas corresponden a estudios donde no se llevó a cabo evaluación por microscopía electrónica, de manera que alteraciones sutiles, aunque diagnósticas, pudieron haberse pasado por alto.
Por otro lado, al considerar las causas no glomerulares, las primeras a tener en cuenta son las neoplásicas, debido a sus implicancias pronósticas y terapéuticas. La frecuencia de cáncer genitourinario se encuentra hasta en el 5% según la mayoría de series publicadas. Dentro de esta categoría se destaca el cáncer de vejiga, cuya forma de presentación en 90% de casos es la hematuria y es el quinto cáncer en orden de frecuencia (7% de cánceres en varones, 3% en mujeres), afectando en algún momento de su vida al 2,4% de la población general y siendo pasible de terapéuticas curativas, con una supervivencia a 5 años del 77,4%. Lamentablemente, el 25% se detecta en estadíos avanzados, disminuyendo las probabilidades de supervivencia. En lo concerniente a la histopatología, el 90% son de origen urotelial (los restantes pueden ser mesenquimáticos, epidermoides o adenocarcinomas). Con respecto a los factores de riesgo para dicha neoplasia, la evidencia reciente apunta fundamentalmente a la edad mayor de 50 años y la historia previa de hematuria macroscópica como los más importantes; mientras que el sexo masculino, el antecedente de tabaquismo, síntomas irritativos vesicales, diversas exposiciones (combustibles diesel, ciertas tinturas, aminas aromáticas, arsénico, etc), haber recibido agentes alquilantes (por ejemplo ciclofosfamida) y un sedimento urinario con >25 GR x CGA, contribuyen también de manera significativa. 1,7 Las frecuencias citadas de cáncer de vejiga en la evaluación de HM van de 0,68% a 3,4%, con un promedio de 2,6%. De todas maneras, estos porcentajes se elevan si aparecen los factores de riesgo mencionados, fundamentalmente la edad y el antecedente de hematuria macroscópica, pudiendo llegar a cifras de 5 – 13% (cifras cercanas al 20% se reportan en casos de hematuria macroscópica activa). De hecho, ante esta eventualidad o el hallazgo de >50 GR x CGA (microhematuria de alto grado), está indicado iniciar inmediatamente la evaluación del árbol urinario sin confirmación adicional de la microhematuria. El carcinoma renal es un hallazgo bastante menos frecuente que el de vejiga en la evaluación de HM (<1 o:p="">1>
Un meticuloso y relativamente reciente estudio de evaluación de HM llevado a cabo por la organización Kaiser Permanente, se encontraron las siguientes etiologías en los 4414 casos sometidos a un examen completo: cáncer de vejiga 2,3%, cáncer renal 0,2%, enfermedad litiásica 16,2%, patología prostática 4%, infección urinaria 2,3%, glomerulopatías 0,9%. Un dato interesante pasible de ser extraído de este estudio señala que la HM con < 25 GR x CGA se acompaña de una probabilidad muy baja de cáncer (0,43%), siempre que no coexistan otras características de alto riesgo, mientras que la HM de alto grado está claramente asociada a riesgo aumentado.10
A pesar del énfasis puesto en la enfermedad maligna debido a motivos obvios, las causas no neoplásicas de HM constituyen la gran mayoría, destacándose las infecciones, los cálculos y la hiperplasia prostática benigna. La frecuencia reportada de enfermedad litiásica va de 1% a 19,5%, de hiperplasia prostática benigna de 1% a 38,7%, y de estenosis uretral de menos del 1% al 7,1%.2 Causas menos frecuentes pueden ocurrir a nivel renal no glomerular, por ejemplo, enfermedades parenquimatosas quísticas, como la enfermedad renal poliquística autosómica dominante, el riñón esponjoso medular, las malformaciones arteriovenosas, la necrosis papilar, las nefritis túbulo-intersticiales, la tuberculosis renal, etc. Otras causas que deben tenerse en mente, particularmente en pediatría y en adultos jóvenes, sobre todo luego de descartar las etiologías más frecuentes, son la hipercalciuria (puede provocar HM, sin haber formado cálculos previos), y el síndrome del cascanueces (“nutcracker”), donde, merced a ciertas anomalías vasculares que condicionan compresión de la vena renal izquierda, se genera HM y/o proteinuria ortostáticos, acompañados de dolor en algunos casos.
Es importante considerar que una proporción variable, pero sin lugar a dudas muy significativa de pacientes, presentará una evaluación con resultados negativos, por lo cual se estará frente a una HM de causa no filiada.
EVALUACIÓN
El primer paso ante un paciente con HM confirmada, es llevar a cabo una prolija anamnesis a fin de excluir alguna de las causas transitorias y benignas (ejercicio físico intenso, menstruación, procedimientos urológicos recientes, etc). Asimismo se debe interrogar sobre la existencia de antecedentes personales y/o familiares de nefropatía. Además, es esencial practicar un adecuado examen físico, incluyendo la determinación de la tensión arterial. Adicionalmente, la mayoría de las recomendaciones apuntan a obtener un urocultivo, y en caso de ser positivo, tratar la infección urinaria y posteriormente reevaluar la presencia de HM luego de seis semanas.
Una vez descartados aquellos factores, si bien la evaluación urológica es el paso primordial en el algoritmo diagnóstico, se deben tener en cuenta ciertos aspectos a analizar a efectos de determinar si se está en presencia de alguna nefropatía, sobre todo si ésta es de origen glomerular. A tales fines, además de la medición de la tensión arterial ya mencionada, se agrega la determinación de marcadores funcionales renales (urea y creatinina), recomendada por todas las guías implicadas. Además, estos marcadores son útiles debido a la probable necesidad inminente de implementar estudios de imagen contrastados o, tal vez, procedimientos terapéuticos que impliquen una reducción de la masa renal funcionante. Respecto al sedimento urinario, ciertos elementos que se mencionarán seguidamente son de gran valor diagnóstico. La aparición en orina de eritrocitos con formas anormales (dismorfia) tradicionalmente ha sido considerada un marcador de daño glomerular y se ha adjudicado al daño mecánico provocado al pasaje a través de los poros de la membrana basal glomerular y posteriormente al daño desencadenado por el ambiente tubular, sometiendo a los hematíes a drásticos cambios de pH y fuerzas osmóticas.11 La presencia de dismorfia eritrocitaria es pasible de ser evaluada por microscopía óptica convencional, la cual se encuentra ampliamente disponible, y también, por microscopía de contraste de fases, siendo ésta el método más idóneo para este cometido. Además de la cuantificación del total de dismorfia, se pueden encontrar morfologías particulares (por ejemplo acantocitosis), a las cuales se les han adjudicado valor diagnóstico per se. Distintos puntos de corte del porcentaje de dismorfia se han tomado en la bibliografía a la hora de considerarlos como predictores del origen glomerular. La mayoría de los estudios publicados, empleando microscopía óptica convencional, mencionan proporciones de dismorfia del 20 al 40%. Un estudio que evaluó 131 pacientes encontró como mejor punto de corte un porcentaje de dismorfia eritrocitaria total de 22%, con sensibilidad del 100%. Otros estudios han apuntado hacia un valor del 40%. La mejor especificidad se logra con dismorfia más de 58%, pero en este punto la sensibilidad decae significativamente (60%).12 Con respecto a la microscopía de contraste de fase, al ser más sensible, requiere puntos de corte más altos. Se citan valores más de 80% para obtener especificidades cercanas al 100%. En lo concerniente a la acantocituria, su mejor valor discriminativo se ha reportado en el orden del 5% al 6%. En todo caso, la dismorfia es un elemento adyuvante al diagnóstico y, más allá de los valores obtenidos, deben interpretarse a la luz de otros indicadores (proteinuria, función renal, tensión arterial, etc.). No se puede finalizar la consideración del sedimento urinario sin mencionar a los cilindros eritrocitarios, cuya presencia en cualquier cuantía es suficiente para certificar el origen glomerular de la hematuria; y la aparición de proteinuria, la cual puede ser manifestación de afección tubular o glomerular siendo una cuantía de rango nefrótico, un hallazgo específico respecto al mismo.
Independientemente de la presencia de indicadores de la génesis glomerular de la HM, éstos no excluyen la presencia de un sangrado de origen no glomerular. De hecho, la AUA, en sus guías sobre HM, sugiere llevar a cabo una evaluación urológica de acuerdo con las características del paciente y sus factores de riesgo para enfermedad neoplásica urológica, más allá de los datos obtenidos en el estudio del sedimento urinario.2
A la hora de emprender la evaluación del tracto urinario, es menester mencionar ciertos aspectos preliminares dignos de ser destacados. En primer lugar, como se ha visto en el capítulo destinado a etiologías, un pequeño porcentaje de pacientes terminarán teniendo una malignidad urológica (más de 5%); incluso en pacientes con factores de riesgo, aunque esta cifra se eleve ligeramente, seguirá constituyendo una pequeña proporción. En segundo lugar, también se ha determinado que la HM constituye un indicador poco fiable de cáncer (sobre todo aquellas con menos de 25 GR x CGA). Por último, la probabilidad de hallar un tumor es aún mucho menor en aquellos pacientes de bajo riesgo (menores de 40 años, no fumadores), muy inferior al 1%. Por otro lado, los estudios a implementar no están exentos de riesgos y complicaciones. El uso de contraste puede dar lugar a reacciones alérgicas, deterioro de la función renal y fibrosis sistémica. La cistoscopía, además de la incomodidad generada, se asocia a un riesgo pequeño pero concreto de urosepsis y estrechez uretral. Debido a lo mencionado, es razonable plantear reparos respecto a la implementación generalizada de una batería completa de exámenes, fundamentalmente en pacientes jóvenes de bajo riesgo. Como se verá, esto se halla en marcado contraste con las recomendaciones de las principales guías urológicas, que indican una evaluación exhaustiva en la gran mayoría de los pacientes, resultando por lo tanto en una enorme cantidad de estudios con resultados negativos.1
Como primera observación, los umbrales de edad para indicar una evaluación urológica completa varían según las guías. La AUA y las guías canadienses indican evaluación exhaustiva con cistoscopía incluida a partir de 35 años en todos los pacientes, independientemente de la presencia de factores de riesgo. También en caso de que existan dichos factores, sin considerar la edad. Para el grupo restante de pacientes, es decir, menores de 35 años sin factores de riesgo, siguen recomendándose los estudios por imágenes, pero la cistoscopía queda a criterio del médico tratante. La Asociación Británica de Cirujanos Urólogos establece un umbral de 40 años. Las guías NICE son las más permisivas, estableciendo el límite de 60 años para el inicio del estudio urológico completo, y para aquellos menores de 45 años, únicamente debería estudiarse el árbol urinario en presencia de hematuria macroscópica. Con respecto al tiempo sugerido para iniciar la exploración, las únicas guías que hacen mención de este tópico son las canadienses y las NICE. Las primeras señalan que la evaluación debería completarse en cuestión de 12 semanas, excepto que exista hematuria macroscópica, en cuyo caso urge realizar todos los procedimientos en un mes. Las guías NICE mencionan que, en caso de sospecha de cáncer, el urólogo debe iniciar la evaluación dentro de 14 días y, si se confirma el diagnóstico, implementar el tratamiento correspondiente dentro de 62 días.13
El primer paso a considerar son los estudios de imagen del árbol urinario. Éstos están destinados a detectar neoplasias del tracto urinario, así como pesquisar la presencia de litiasis o focos infecciosos del mismo. Existen diversos métodos disponibles. Se mencionará en primer lugar la Urografía por Tomografía Computada Multifase (fase no contrastada, seguido por bolo de contraste de 100 a 150 ml con fase parenquimatosa renal a 100 segundos de la inyección del contraste y fase excretora a los 10 a 20 minutos) abarcando desde el polo superior de los riñones hasta la sínfisis pubiana, que permite evaluar secuencialmente el tejido renal y posteriormente el urotelio y la vejiga. Se recomiendan cortes renales cada 3 a 5 mm, aunque el 73% de cánceres uroteliales miden igual o menos de 5 mm, por lo que en uréteres y vejiga los cortes se sugieren de 1,25 a 3 mm. La AUA considera este estudio como de primera elección en absolutamente todos los pacientes en evaluación por HM asintomática ya que posee la mayor sensibilidad (91-100%) y especificidad (94-97%)2 para detectar patología del tracto urinario superior. En cambio, las guías canadienses desalientan su uso merced a los altos costos y riesgos implicados con la exposición a radiaciones y contraste, proponiendo como método de estudio inicial la ecografía renal y vesicoprostática, reservando la tomografía de entrada a aquellos con hematuria visible o síntomas asociados. Particularmente se ha reportado un 0,4% de riesgo de cáncer iatrogénico vinculado a exposición a tomografía computada, sobre todo en pacientes jóvenes (menos de40 años). Teniendo esto en cuenta, algunos autores propusieron protocolos de tomografía no contrastada con baja dosis de radiación, encontrando resultados similares en detección de neoplasia urológica en pacientes < 50 años (riesgo de pasar por alto un cáncer menos de1%), por lo cual sería una opción razonable en estos pacientes.1,13
Respecto a la ecografía, constituye un método con menor sensibilidad, sobre todo en aquellas lesiones menores de 1 cm (21% versus 60% de la tomografía contrastada). Su sensibilidad global para cáncer es del 67%. Sin embargo, es fiable para la detección de masas renales de mayor tamaño, pólipos y lesiones vesicales, para diferenciar lesiones sólidas de quísticas, y permite asimismo detectar litiasis con moderada eficiencia. Su desempeño más pobre es a nivel del urotelio de los uréteres. Hemos visto cómo las guías canadienses consideran la ecografía como de primera elección en la pesquisa diagnóstica. Tiene la ventaja de la inocuidad.
La Urografía por Resonancia Magnética es un método menos utilizado debido a su alto costo, limitación de disponibilidad, y ausencia de protocolos estandarizados. Además, es un pobre detector de litiasis, la cual es una causa frecuente de HM. Aporta una excelente resolución del parénquima renal pero no sucede lo mismo en uréteres y vejiga, donde su rendimiento es menor que el de la tomografía contrastada en fase excretora. Su sensibilidad ha sido reportada como del 90% para detectar masas renales, y de un 80% para tumores del urotelio, cuando se utiliza gadolinio. Su utilidad queda limitada a aquellos pacientes que presentan contraindicaciones a la tomografía (por ejemplo, alergia al contraste iodado) y que requieren una exploración más profunda que la que ofrece la ecografía.1
Habiendo trazado un panorama de las técnicas de imagen disponibles y los beneficios y riesgos que aporta cada una dentro de cada grupo de pacientes, estamos en condiciones de trazar un esquema general de evaluación, sometiendo a un espíritu crítico las recomendaciones mencionadas en las guías. En primer término, aquellos pacientes jóvenes menores de 40 años (riesgo de neoplasia ínfimo, menos de 1%), con HM asintomática y ausencia de factores de riesgo, podrían ser evaluados con una sistemática que se limite a una ecografía renal, vesical y prostática. En aquellos mayores de dicha edad y/o que presenten factores de riesgo, será menester iniciar la exploración con Urografía por Tomografía Computada Multifásica como se ha descripto. En pacientes con alergia a contrastes iodados o contraindicación a la exposición a radiaciones, como en el embarazo, se podrá recurrir a la Urografía por Resonancia Magnética. Se debe recordar que ésta última está contraindicada en presencia de alergia al gadolinio, claustrofobia o algunos dispositivos implantables metálicos. En pacientes con insuficiencia renal moderada a severa no se podrá emprender la exploración por tomografía con contraste o resonancia, ya que tanto los contrastes iodados como el gadolinio se asocian a efectos adversos concretos (deterioro de función renal, fibrosis sistémica nefrogénica). En estos casos, se puede recurrir a una tercera opción, que consiste en combinar una ecografía renal (que aporta una buena evaluación del parénquima renal), con una tomografía sin contraste o una pielografía retrógrada, que permitirán una razonablemente adecuada evaluación del urotelio.1,2
Respecto a la cistoscopía, configura el paso siguiente luego de las imágenes del árbol urinario. Es un procedimiento relativamente simple, que puede llevarse a cabo generalmente con anestesia local. Es el método fundamental para diagnosticar el cáncer de vejiga, que como hemos visto, es la principal neoplasia a investigar en la HM. La cistoscopía con fluorescencia, utilizando una sustancia fotosensibilizante, ayuda a identificar lesiones planas que podrían pasarse por alto en la cistoscopía convencional. Conlleva un 5% de riesgo de infección urinaria.14 Ya se han comentado sus indicaciones por parte de la AUA, que recomienda dicho estudio en los pacientes más jóvenes (a partir de 35 años). Las guías británica y japonesa lo indican a partir de los 40 años. La Asociación Alemana de Urología la recomienda a partir de los 50 años, mientras que, en menores de dicha edad, queda a criterio del médico tratante. Dentro del otro extremo del espectro propuesto de evaluación, se encuentran las recomendaciones suecas y de las guías escocesas sobre enfermedad renal crónica, que sugieren no aplicar de rutina la cistoscopía, sino hacerlo en aquellos casos que ameriten según el criterio profesional.
Otro aspecto a tener en cuenta es la citología urinaria. No es recomendada en ninguna de las principales guías urológicas. Esto se debe a su baja sensibilidad (0 – 76%) respecto a la cistoscopía (91%). Dicha característica se da sobre todo en aquellos cánceres uroteliales de bajo grado, que constituyen casi dos tercios del total. En los de alto grado, su desempeño mejora, pero sigue siendo superada por la cistoscopía. Además, su especificidad puede ser tan baja como el 62,5%, dando lugar a un número no despreciable de falsos positivos. La única ventaja radica en el diagnóstico del carcinoma in situ, que puede ser pasado por alto en la cistoscopía, pero sólo constituye el 3% de cánceres de novo. Además, existen importantes limitaciones debido a que es un método dependiente de operador, ya que se encuentra condicionado por la habilidad y experiencia del citólogo. Las guías de la AUA reservan su uso en caso de alta probabilidad de cáncer in situ, particularmente en el contexto de HM persistente luego de una evaluación inicial negativa.2
Se hará mención de los marcadores tumorales. Se han desarrollado varios, en un intento de mejorar la detección no invasiva de tumores del tracto urinario. Algunos de ellos son NMP22, BTA-stat y UroVysion FISH. Sin embargo, no han podido superar el rendimiento de la cistoscopía, y por lo tanto ninguna de las guías destacadas lo recomienda dentro del algoritmo de estudio de la HM.
Otro aspecto a evaluar luego de haber descartado patologías orgánicas del árbol urinario, es la presencia de alteraciones metabólicas urinarias que pudieran provocar HM, fundamentalmente la hipercalciuria. Por ello, es conveniente incluir en la evaluación, un perfil metabólico para litiasis.
Finalizada la evaluación mencionada, es posible que ésta haya arrojado un resultado negativo, sin haber podido arribar a un diagnóstico etiológico. Dicha situación es harto frecuente, llegando en muchas series a representar la mayoría de la casuística reportada (43% – 68%).3
Esta eventualidad constituye un desafío adicional para el médico, ya que debe plantearse la posibilidad de una patología subyacente que haya sido pasada por alto en la evaluación, condicionando tal vez la repetición de los métodos diagnósticos. Asimismo, genera desconcierto en el paciente, al enfrentarse a una alteración sin diagnóstico, y ansiedad, producto de una putativa entidad nosológica que tal vez comprometa su vida y que no ha podido ser hallada.
Ante la vicisitud mencionada, las guías sobre HM de la AUA recomiendan repetir anualmente un sedimento urinario por dos años al menos, y en caso de que se certifique la presencia de HM persistente, se debería emprender una reevaluación completa del árbol urinario cada tres a cinco años. Sin embargo, se trata de una recomendación basada en opinión de expertos.2 En un estudio, se evaluó a 234 pacientes mayores de 50 años con factores de riesgo para cáncer de vejiga, que habían sido sometidos a evaluación rigurosa por HM arrojando resultado negativo. De ellos, sólo dos (0,85%), se diagnosticaron posteriormente de cáncer vesical, uno a los 6 y otro a los 11 años. Además, se comparó con una cohorte de 1076 sujetos con características basales similares, pero sin HM, y se halló que 10 de ellos (0,93%) terminaron diagnosticándose de cáncer de vejiga en el seguimiento. La conclusión de los autores es que luego de la evaluación inicial negativa, no estaría indicado proseguir con exámenes adicionales, merced a una frecuencia de neoplasia igual a la población comparable sin HM.15 Otro estudio retrospectivo, enfocó la misma cuestión de la evaluación inicial negativa en HM, pero en este caso, en pacientes sin factores de riesgo para cáncer urotelial. Incluyó 87 sujetos sometiéndoles a examen de sedimento urinario anual, que evidenció HM persistente y reevaluación del árbol urinario a los tres años, como recomiendan las guías de la AUA. De ellos, 5 (5,6%) desarrollaron proteinuria, practicándose biopsia renal y hallándose un caso de nefropatía IgA, uno de necrosis papilar y tres de enfermedad renal crónica, dos de los cuales terminaron requiriendo tratamiento dialítico. Respecto a los tumores, no se diagnosticó ningún cáncer de vejiga, y en un caso (1,1%) se halló un adenocarcinoma de próstata.16 Otros elementos de la bibliografía disponible, también sugieren que la abrumadora mayoría de pacientes con una evaluación rigurosa inicial negativa, permanecerán libres de cáncer a largo plazo. Por lo tanto, si no se repite la HM o el paciente reúne características de muy bajo riesgo, no sería necesario emprender estudios adicionales para investigar el episodio inicial, excepto en pacientes de alto riesgo con cambios del escenario clínico (por ejemplo, incremento del grado de HM, macrohematuria, dolor, síntomas irritativos vesicales, etc.)
ROL DE LA BIOPSIA RENAL
Luego de haber repasado la pléyade de posibilidades etiológicas de la HM, queda claro que ésta representa un desafío diagnóstico tanto para el urólogo como para el nefrólogo. Ya se mencionaron en particular las posibles entidades glomerulares que pueden generar este signo. Habiendo descartado por estudios de imagen, cultivos pertinentes, y, en caso necesario, cistoscopía, enfermedades del parénquima no glomerulares (quistes, necrosis papilar, hipernefroma, tuberculosis) y patología del tracto urinario, se llega al punto de considerar la práctica de la biopsia renal.
La aplicación de tal procedimiento en el contexto de HM no se encuentra estandarizado en las guías y se trata de un tópico sometido a continuo debate. Quienes argumentan en favor de su utilización opinan que se trata de un procedimiento seguro, con una baja tasa de complicaciones; que permite un diagnóstico certero en casos de HM familiar, obviando la necesidad de estudiar al resto de miembros; y que en aproximadamente la mitad de los pacientes se encuentran glomérulos normales, al menos por microscopia óptica (en dicho caso el paciente no requeriría adicional seguimiento nefrológico). Por otra parte, los detractores afirman que es un procedimiento invasivo, y como tal, no exento de eventos adversos; que los posibles diagnósticos glomerulares no llevarán aparejada una conducta terapéutica específica, sino un seguimiento nefrológico regular con instauración de medidas nefroprotectoras generales en cualquier caso; y que, en última instancia, la HM de origen glomerular se caracteriza por un excelente pronóstico a largo plazo.9
A continuación, se apelará a la evidencia disponible a fin de someter a escrutinio tales afirmaciones y valorar el papel preciso que podría desempeñar la biopsia renal. Respecto a lo último mencionado, el pronóstico renal a largo plazo, dada su trascendencia, se le dedicará el siguiente capítulo de esta revisión.
En lo relativo a los riesgos inherentes a la práctica, en sujetos típicos con HM asintomática aislada, los eventos adversos son poco comunes. En una revisión reciente sobre biopsia renal se destaca una serie de factores de riesgo para complicaciones ligadas al procedimiento (aguja 14F, edad menores de 40 años, creatinina mayor de 2mg%, presión sistólica mayor de 130 mmHg, hemoglobina menor de 12g%). Las complicaciones son: hematuria macroscópica 3,5%, hematoma perirrenal pequeño detectado por tomografía 57-91%. Las complicaciones graves son muy infrecuentes, incluyendo: necesidad de transfusión 0,9%; nefrectomía 0,01%; muerte 0,02%.17
Ya se ha adelantado en el capítulo de etiología algunas cifras respecto a los hallazgos histopatológicos en la biopsia renal. Se citará aquí un estudio de Japón, donde se practicaron biopsias renales a 56 pacientes con HM y función renal normal. Cabe mencionar que 16% tenían historia de hipertensión arterial, y un 33% antecedentes de algún episodio de hematuria macroscópica. El resultado fue un predominio marcado de nefropatía IgA (62%), seguida por enfermedad de membrana basal fina (13%), anomalías glomerulares mínimas (11%), anomalías inespecíficas de la membrana basal (9%) y algunos casos de nefroesclerosis. Respecto a la nefropatía IgA, es menester destacar que se hallaron adhesiones en un 10% y semilunas de diverso tipo en el 15,8% de los glomérulos. Hubo 3 pacientes que tenían concomitantemente nefropatía IgA y síndrome de cascanueces. Se encontraron como factores predictivos de nefropatía IgA, la presencia de proteinuria >80 mg/d, edad promedio de 27 años y nivel sérico de IgA mayor de 213 mg/dL.18 En otro estudio, se evaluó a 45 potenciales donantes vivos de riñón con HM asintomática mediante biopsia renal, luego de haber descartado patología del árbol urinario mediante tomografía y cistoscopía. Un 62% de los sujetos tenían hallazgos normales, un 29% enfermedad de membrana basal fina, y 9% nefropatía IgA.19
Otros reportes también han señalado como elemento predictor de IgA, en desmedro de la enfermedad basal fina, la presencia de cantidades al menos pequeñas de proteinuria. En un estudio, la presencia concomitante de proteinuria menor de 2,5 g/día tornó mucho más probable la nefropatía IgA (casi 50%), en segundo lugar, otras glomerulonefritis (26%); relegando enormemente a la enfermedad de membrana basal fina (7%). Por otro lado, la presencia de microalbuminuria sin proteinuria, equiparó ambas enfermedades (46 y 48% respectivamente), mientras que, ante la ausencia de microalbuminuria, el dominio abrumador fue de la enfermedad de membrana basal fina (89%).20
Un estudio evaluó el valor de la biopsia renal en 111 pacientes con HM aislada, de los cuales se biopsiaron 75. Se hallaron los siguientes casos: 27 de membrana basal fina, 17 de nefropatía IgA, 7 de glomerulonefritis mesangio proliferativa inespecífica, 8 con anomalías glomerulares leves y 3 de glomeruloesclerosis global y focal. Se encontraron como predictores clínicos de nefropatía IgA, el antecedente de hematuria macroscópica y el nivel sérico de IgA (muy específico, pero poco sensible). Además, se comparó tanto a los pacientes con y sin biopsia, en base a un seguimiento regular anual durante casi cuatro años, no encontrándose diferencias en resultados clínicos (tensión arterial, desarrollo de proteinuria o insuficiencia renal), ni en medidas de manejo nefrológico.21
Otro estudió evaluó 135 pacientes con HM, de los cuales 89 tenían HM aislada, y 46 HM con proteinuria (0,3 – 2,49 g/día). En el primer grupo predominó nuevamente la membrana basal fina (43%) y la nefropatía IgA (20%), con un 18% de biopsias normales. Los hallazgos fueron distintos en aquellos con proteinuria, encontrándose un 46% de glomerulopatías adicionales, destacándose la glomeruloesclerosis focal y segmentaria (13%) y, algunos casos de nefropatía membranosa y glomerulonefritis membranoproliferativa. Asimismo, fue frecuente en este grupo la nefropatía IgA (45,7%), mientras que la membrana basal final y los glomérulos normales se redujeron a escasos pacientes.22
Otro aspecto a destacar, que mencionan algunos de estos estudios, es que en una proporción significativa de pacientes (17 – 40%) la HM desaparece en el seguimiento posterior.
Resumiendo la evidencia citada, se puede decir que, en condiciones de HM aislada, la práctica de la biopsia renal permitirá un diagnóstico certero en la mayoría de casos. De manera prácticamente unánime, la nefropatía IgA y la enfermedad de membrana basal final contribuyen conjuntamente a más del 50% de los casos. Sin embargo, no aportará información crucial que determine cambios importantes respecto a la terapéutica nefrológica ni a la pauta de seguimiento. Las glomerulopatías halladas, en su gran mayoría, no requieren terapias específicas, siempre que se expresen clínicamente como HM aislada, sin hipertensión arterial, proteinuria y/o deterioro de la función renal. Por lo tanto, no se cumplen dos premisas básicas en la indicación de una biopsia renal. En primer lugar, la práctica de la misma debería implicar que el diagnóstico permita modificar la historia natural mediante terapéuticas específicas; y, en segundo lugar, que dichas intervenciones sean distintas para los diversos diagnósticos que podrían lograrse. Tal vez la única indicación fuerte de biopsia en este contexto sea la evaluación de HM en candidatos a donante vivo de riñón, en quienes la opinión mayoritaria es verificar la indemnidad glomerular.
Distinta es la situación en caso de aparición concomitante de otras características, además de la HM, particularmente la presencia de proteinuria, incluso de bajo grado. Entonces, es factible una ampliación del espectro diagnóstico, como otras glomerulopatías o una nefropatía IgA más avanzada (riesgo de enfermedad renal crónica terminal 25 – 35% a 10 años con proteinuria mayor a 1 g/día; 40% con proteinuria mayor de 2 g/día; 60% con proteinuria mayor de 3 g/día), las cuales podrían ameritar un enfoque terapéutico distinto, por ejemplo, la instauración de un tratamiento inmunosupresor.
Desde el punto de vista nefrológico, un plan de seguimiento lógico sería reexaminar al paciente anualmente, mientras persista la HM. En cada oportunidad se estudiará el sedimento urinario, y se determinarán la tensión arterial y la función renal. Ante la aparición de proteinuria, hipertensión arterial o caída de la tasa de filtrado glomerular; se debería practicar una biopsia renal.
En el siguiente capítulo, se tratará sobre la historia natural y el pronóstico a largo plazo de los pacientes con HM. Se verá cómo la evidencia disponible difiere en alguna medida del concepto tradicional, que señalaba un pronóstico excelente en todos los casos. Sin embargo, la revisión de este tópico no alterará las conclusiones sobre biopsia renal escritas en los párrafos anteriores, ya que no se modifican las premisas señaladas respecto a la utilidad diagnóstica y terapéutica de la misma.
HEMATURIA MICROSCÓPICA GLOMERULAR: HISTORIA NATURAL Y PRONÓSTICO
Como se ha señalado anteriormente, tradicionalmente se ha considerado a la HM aislada asintomática persistente como una entidad con un excelente pronóstico renal a largo plazo. No obstante, es escasa la evidencia publicada en la bibliografía donde se haya evaluado el derrotero de estos pacientes en lapsos de tiempo verdaderamente prolongados. Algunas de las glomerulopatías que ocasionan esta condición, pueden tener una evolución negativa en una proporción no despreciable de casos, particularmente cuando se añade la aparición de proteinuria en las alteraciones urinarias.
En este capítulo, se expondrá la evidencia disponible respecto a esta controvertida cuestión, para finalmente intentar extraer alguna conclusión definitiva en lo relacionado a este tópico.
En primer lugar, se apelará al estudio que, desde el punto de vista del número de pacientes incluidos, y el prolongado seguimiento realizado, se podría considerar como el más importante en este tema. De hecho, es citado por prácticamente todos los trabajos recientes que versan sobre HM. Se trata de un estudio de cohorte, retrospectivo, poblacional, realizado en Israel. Incluyó 1203626 reclutas del servicio militar de entre 16 y 25 años de edad, a quienes se realizó screening diagnosticándose y confirmándose 3690 (0,3%) casos de HM persistente. Se excluyó a aquellos con patologías sistémicas, hipertensión arterial, enfermedades del árbol urinario, deterioro de la función renal y proteinuria mayor de 200 mg/día. De manera que se trató de una población por lo demás sana, con HM aislada asintomática. El seguimiento superó 20 años, y consistió en comparar cuántos pacientes con y sin HM evolucionaban a enfermedad renal en estadío terminal. Básicamente, esto se hizo analizando la base de datos del Registro Isrealí de Nefropatía Terminal. En aquellos con HM persistente hubo 26 (0,7%) de casos de nefropatía terminal. En aquellos sin HM hubo 539 (0,04%) de casos. El Hazard Ratio ajustado según variables determinó un riesgo 18,5 veces mayor de desarrollar enfermedad renal crónica terminal en aquellos con HM persistente. El estudio concluye señalando que la HM persistente constituye un fuerte factor de riesgo para el desarrollo de enfermedad renal crónica terminal, particularmente a partir de glomerulopatías primarias.6
Un estudio coreano, unicéntrico, evaluó retrospectivamente a 350 pacientes con HM aislada a quienes se practicó biopsia renal. Los resultados a largo plazo que se analizaron fueron: caída de tasa de filtrado glomerular a <60 aparici="" de="" min="" ml="" n="" o="" proteinuria="" y="">300 mg/día. Los hallazgos histológicos fueron los siguientes: predominó la nefropatía IgA (46,9%), seguida por glomerulonefritis mesangio proliferativa idiopática (43,1%). El resto de diagnósticos fueron infrecuentes y comprendieron glomeruloesclerosis focal y segmentaria, glomerulonefritis membranoproliferativa, nefropatía membranosa, nefropatía IgM, membrana basal fina y cambios glomerulares leves o normalidad total. El seguimiento en promedio fue apenas superior a 7 años. Luego de realizar el análisis de datos, se evidenció que hubo un empeoramiento estadísticamente significativo, aunque con promedios aún dentro de los parámetros de normalidad, respecto a la tensión arterial, creatinina sérica, nivel de filtrado glomerular y proteinuria. Respecto a los eventos duros pesquisados, se desarrolló proteinuria en 10 pacientes (todos ellos diagnosticados con nefropatía IgA), y deterioro del filtrado glomerular a un nivel menor de 60 ml/min en 3 pacientes (1 con nefropatía IgA, otro con nefropatía mesangial idiopática y finalmente un paciente con glomérulos normales pero cambios tubulointersticiales crónicos y severos). Estos hallazgos demostraron un riesgo aumentado para desarrollar proteinuria en aquellos con nefropatía IgA. Respecto al desarrollo de enfermedad renal crónica, ésta se dio en menos del 1% de los pacientes, sugiriendo un curso benigno para la HM persistente, pero los autores reconocen que el período de seguimiento no fue lo suficientemente largo para evaluar adecuadamente el impacto probable sobre la función renal.2360>
En otra publicación coreana, se realizó un seguimiento prospectivo de 90 pacientes con HM aislada, investigando el desarrollo ulterior de proteinuria mayor de 500 mg/día, hipertensión arterial y/o enfermedad renal crónica (filtrado glomerular menor de 60 ml/min). El seguimiento promedio fue de 5,2 años. Únicamente se realizó biopsia en 28 pacientes, diagnosticándose nefropatía IgA, enfermedad de membrana basal fina, y glomérulos normales en proporciones similares. En el seguimiento, 22% de los pacientes desarrollaron uno o varios eventos adversos. Hubo un 13% de incidencia de hipertensión arterial, 11% de proteinuria, y 0,9% de deterioro de la función renal. Al analizar las diferentes variables, se observó que el riesgo de desarrollar dichos eventos aumentó marcadamente en aquellos pacientes con mayor índice de masa corporal, proteinuria basal mayor de 100 mg/día, y altos niveles séricos de ácido úrico. Un dato interesante es que el pronóstico, al final del seguimiento, no varió entre aquellos pacientes a quienes se practicó biopsia renal en comparación con quienes no se llevó a cabo tal procedimiento.24
En definitiva, la evidencia disponible aporta fundamentos para considerar que la HM aislada persistente no sigue un curso evolutivo tan favorable como anteriormente se consideraba. Existe una potencial naturaleza progresiva de la enfermedad renal, cualquiera sea la etiología subyacente, la cual puede inicialmente presentarse como HM aislada, desarrollando con el tiempo otras características adicionales. De hecho, es perfectamente razonable considerar a la HM aislada persistente como enfermedad renal crónica, incluyéndola dentro del epíteto de alteraciones del sedimento urinario, según lo establecen las guías KDIGO 2012 sobre enfermedad renal crónica. Esto sirve para realzar el potencial significado pronóstico de esta condición y la necesidad de seguimiento, aunque dichas guías terminen en cierta forma brindando un mensaje contradictorio al no considerar a la HM sin proteinuria como un factor de progresión de la enfermedad renal.25 Debido a que no son aplicables intervenciones terapéuticas específicas y adecuadas a las diversas etiologías hallables, como se ha comentado en el capítulo anterior, los esfuerzos deben ser puestos sobre un seguimiento anual del paciente, pesquisando indicios de progresión del daño renal, tomando las medidas pertinentes. Coligiendo ciertos datos de los estudios resumidos, es razonable ejercer una vigilancia más estrecha y cuidadosa sobre aquellos pacientes que expresan algunas características que pueden ser consideradas de mayor riesgo. Se trata de quienes tengan un mayor índice de masa corporal, tensión arterial más elevada, excreción urinaria diaria de proteínas más alta y mayor uricemia; incluso aunque dichos valores se encuentren dentro del rango de referencia normal.
Cierto es que las diferentes glomerulopatías que provocan HM glomerular aislada y persistente, pueden seguir su evolución fisiopatológica particular y, por ende, provocaran el daño glomerular y tubulointersticial propio de cada una de ellas. Sin embargo, se debe tener en cuenta que la HM glomerular persistente, per se, es capaz de poner en marcha mecanismos de daño independientes de la etiología subyacente, y esto puede, en última instancia, determinar el pronóstico a largo plazo. Esto ha sido objeto de una reciente e interesante revisión sobre el tema. Según la investigación básica, el pasaje de los glóbulos rojos a través de la membrana basal glomerular genera distorsión del citoesqueleto eritrocitario, promoviendo la lisis celular, con la consiguiente liberación en el fluido tubular de hemoglobina, hierro libre y grupos hemo. La hemoglobina liberada es internalizada en las células tubulares por el complejo megalina – cubilina. En condiciones normales, la enzima hemo-oxigenasa-1 degrada el hemo a biliverdina, que posteriormente pasa a bilirrubina, y hierro, el cual se almacena como ferritina. En condiciones de HM persistente, la capacidad de la hemo-oxigenasa-1 se ve saturada, y el hemo y el hierro libre despliegan su potencial oxidante. El hierro libre oxida lípidos, desnaturaliza proteínas y degrada la membrana celular. El grupo hemo tiene efectos indirectos proinflamatorios y fibróticos, y disminuye la disponibilidad de óxido nítrico, generando vasoconstricción e isquemia renal. Estos mecanismos, entonces, podrían contribuir a un mecanismo patogénico directo de la hematuria glomerular.26
CONCLUSIONES
Como corolario de todo lo desarrollado a lo largo de esta revisión, se intentará extraer una serie de conclusiones sucintas, claras y útiles para la práctica cotidiana.
En primer lugar, es dable señalar que se trata de una anomalía común y prevalente en la población general. Actualmente, la definición operativa que se toma de manera mayoritaria, y que se debería aplicar, es la presencia de más de 2 GR x CGA en la microscopía del sedimento. Siempre debe confirmarse un dipstick positivo con microscopia del sedimento urinario y descartarse mediante cultivo la presencia de una infección urinaria. También es recomendable confirmar la persistencia de la HM en al menos dos sedimentos, aunque enfermedades serias del árbol urinario pueden dar HM intermitente. En consideración a esta eventualidad aquellos pacientes con factores de riesgo, deberían ser estudiados sin dilación ni necesidad de confirmar el hallazgo. El screening no es recomendado por ninguna sociedad urológica ni nefrológica, ya que la evidencia disponible no indica que mejore la sobrevida en caso de detectar la presencia de cáncer urológico, incluso en poblaciones de alto riesgo; y por la desproporcionada cantidad de falsos negativos que dicha intervención supondría.
Respecto a la evaluación, debe estar destinada fundamentalmente a la detección de patología del árbol urinario. Aunque existe gran diversidad de criterios en las guías de las distintas sociedades de urología, a grandes rasgos, se pueden diferenciar dos grupos de pacientes: aquellos mayores de 40 años, con características de riesgo adicionales, en quienes es recomendable llevar a cabo una exhaustiva y completa investigación que incluya procedimientos tomográficos y cistoscopía. Mientras que, en pacientes más jóvenes, sería suficiente con un enfoque más conservador basado fundamentalmente exámenes ecográficos. En lo concerniente a un resultado negativo de la evaluación, si ésta fue rigurosa, el riesgo remanente de neoplasia es despreciable y no ameritaría una nueva evaluación, excepto en pacientes con HM persistente y características de riesgo, en cuyo caso es recomendable una reevaluación cada 3 a 5 años.
Posteriormente, ante la negatividad de los estudios mencionados, habiendo descartado causas malignas y benignas del tracto urinario, el paciente debería ser evaluado por un nefrólogo, si a esta altura no había sido evaluado por un especialista. La derivación a dicho profesional debería ser al momento de detectar HM en caso de características que hacen factible suponer un origen glomerular, como por ejemplo dismorfia, antecedentes familiares, edad joven, o indicadores de nefropatía clínica (hipertensión arterial, presencia de proteinuria o descenso de la función renal). La evaluación nefrológica debe tener por objetivo indagar la presencia de enfermedad renal no glomerular (fundamentalmente por métodos de imagen), y, sobre todo, pesquisar la ocurrencia de patología glomerular.
En el capítulo sobre biopsia renal, se apreciaron las controversias que merodean sobre dicha práctica en el caso de HM aislada. Luego de resumir la evidencia disponible, se puede afirmar que, si bien el rédito diagnóstico es excelente, los resultados obtenibles a partir de una biopsia renal revisten una utilidad nula o escasa respecto a implicancias terapéuticas y/o pronósticas. Tampoco parece tener un impacto sobre la evolución de los pacientes, haber realizado o no dicho procedimiento al momento de detectar la HM. Por lo tanto, no sería recomendable aplicar la punción biopsia renal a los casos de HM aislada persistente en pacientes por lo demás sanos. Sí lo es en aquellos con las características adicionales ya mencionadas, fundamentalmente proteinuria, ya que el espectro diagnóstico y las implicancias terapéuticas se amplían.
Finalmente, el eje de la discusión se centró sobre la evolución a largo plazo de estos pacientes. Contrariamente al concepto tradicional, la evidencia reciente señala que éstos pacientes, a lo largo de seguimientos muy prolongados (décadas) tienen un riesgo incrementado de desarrollar eventos adversos renales, como proteinuria y descenso de la función renal, incluso llegando al estadío de enfermedad renal crónica terminal. Por lo tanto, el nefrólogo debe considerar a los pacientes con HM aislada persistente como una población en riesgo, y, consecuentemente, promover su seguimiento frecuente, anual. En cada evaluación, además de repetir el sedimento urinario, se deben determinar la presión arterial y la función renal. Cualquier característica que sugiera una nefropatía en evolución debería suscitar un enfoque más activo, incluyendo biopsia renal, y las medidas terapéuticas específicas que amerite la situación, ya que en dicho momento aparecería la oportunidad de brindar medidas efectivas para mejorar el pronóstico renal.
Bibliografía
1. Sountoulides P, Mykoniatis I, Metaxa L. Non-visible asymptomatic haematuria: a review of the guidelines from the urologist’s perspective., Expert Review of Anticancer Therapy 2017.
2. Davis R. et al. Diagnosis, evaluation and follow-up of asymptomatic microhematuria (AMH) in adults: AUA Guideline. 2012.
3. Cohen RA, Brown RS. Clinical practice. Microscopic hematuria. The New England Journal of Medicine. 2003; 348 (23): 2330-2338.
4. Lynch TH et al. Repeat testing for haematuria and underlying urological pathology. British Journal of Urology. 1994; 74(6):730-732.
5. Rao PK et al. Dipstick pseudohematuria: unnecessary consultation and evaluation. The Journal of Urology. 2010; 183(2):560-564.
6. Vivante A et al. Persistent asymptomatic isolated microscopic hematuria in israeli adolescents and young adults and risk for end stage renal disease. JAMA. 2011; 306(7):729-736.
7. Niemi M, Cohen R. Evaluation of microscopic hematuria: a critical review and proposed algorithm. Advances in Chronic Kidney Disease. 2015: Vol 22, No 4 (July), pp 289-296.
8. Sparwasser C et al. Significance of the evaluation of asymptomatic microscopic haematuria in young men. Br J Urol. 1994; 74:723-9.
9. Feehally J. Investigating microscopic haematuria – the role of renal biopsy. BANTAO Journal 2007; 5 (2) : 10–13.
10. Loo RK et al. Stratifying risk of urinary tract malignant tumors in patients with asymptomatic microscopic hematuria. Mayo Clin Proc. 2013;88(2):129-138.
11. Fogazzi G. The urinary sediment. An integrated view. 2010. 3rd. Edition. Elsiever.
12. Gaste Martinez M et al. Comparison of different methods of erythrocyte dysmorphism analysis to determine the origin of hematuria. Nephron Clin Pract 2014;128:88–94.
13. Linder B et al. Guideline of guidelines: asymptomatic microscopic haematuria. BJU Int 2018; 121: 176–183.
14. Sharma S, Ksheersagar P, Sharma P. Diagnosis and treatment of bladder Cancer. American Family Physician 2009; 717-723.
15. Messing E Madeb R et al. Long‐term outcome of hematuria home screening for bladder cancer in men. Urology 2010; 75: 20-26.
16. Pilcher R et al. The need for repeated urological evaluation in low-risk patients with microscopic hematuria after negative diagnostic work-up. Anticancer Research. 2013; 33: 5525-5530.
17. Hogan J, Mocanu M, Berns J. The native kidney biopsy: update and evidence for best practice. Clin J Am Soc Nephrol. 2015; 10: 1-9.
18. Hoshino Y et al. Renal biopsy findings and clinical indicators of patients with hematuria without overt proteinuria. Clin Exp Nephrol. 2015; 19:918–924.
19. Hassan EA et al. Histopathologic findings of potential kidney donors with asymptomatic microscopic hematuria: impact on donation. Transplantation Proceedings. 2017; 49:1729-1732.
20. Eardley KS et al. Urinary albumin excretion: a predictor of glomerular findings in adults with microscopic haematuria. QJM. 2004 May;97(5):297-301.
21. Mc Gregor D et al. Clinical audit of the use of renal biopsy in the management of isolated microscopic hematuria. Clinical Nephrology. 1998; 49:345-348.
22. Hall CL et al. Clinical value of renal biopsy in patients with asymptomatic microscopic hematuria with and without low-grade proteinuria. Clin Nephrol. 2004 Oct;62(4):267-72.
23. Lee HM et al. The natural course of biopsy-proven isolated microscopic hematuria: a single center experience of 350 patients. J Korean Med Sci 2016; 31: 909-914.
24. Chow K et al. Asymptomatic isolated microscopic haematuria: long-term follow-up. Q J Med 2004; 97:739–745.
25. KDIGO 2012 Clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney International Supplements (2013) 3, 136–150.
26. Yuste C et al. Pathogenesis of glomerular haematuria. World J Nephrol 2015 May 6; 4(2): 185-195.