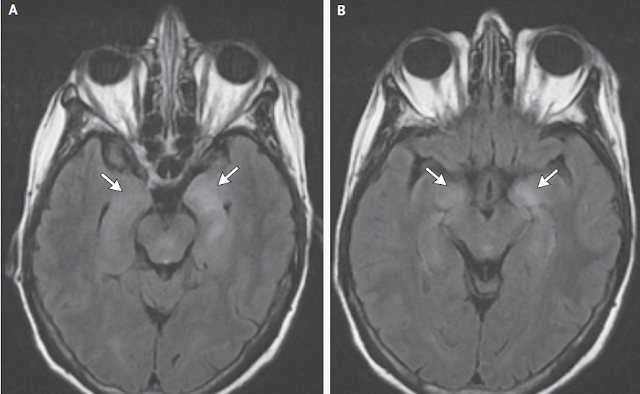
Paciente masculino 31 años
MOTIVO DE INTERNACIÓN: Fiebre, náuseas,vómitos, rash cutáneo
ANTECEDENTES: tabaquismo de 10 cigarrillos por día con cese del hábito tabáquico dos semanas antes de la internación.
No refiere conductas de riesgo ni viajes
Trabaja en la cocina de un restaurante y en los ratos libres restaura muebles antiguos
ENFERMEDAD ACTUAL:
Paciente que comienza a presentar síndrome febril 2 semanas antes de la consulta, rash cutáneo asociado al aumento de temperatura que en la última semana se asoció a nauseas y vomitos. Consulta a su medico de cabecera quien por la sospecha de cuadro de vías aéreas indico levofloxacina 750 que tomo por 5 dias. Al persistir la fiebre consulta y se decide internación
EXAMEN FÍSICO:
Al examen físico el paciente se encontraba febril 39°C con el resto de los signos vitales normales. Como datos positivos se auscultaban sibilancias aisladas en ambos campos pulmonares. Abdomen blando depresible dolorso a la palpacion profunda de flanco y fosa iliaca izquierda puño percusión izquierda positiva. Maculas eritematosas no pruriginosas vitropresion negativa que tienden a confluir que iniciaron en la cara y que descendieron hacia tronco y extremidades, Este rash se inicia junto con la fiebre
RX TORAX normal
LABORATORIO 18/09/2018
GR 4.200.000; Hto 39; Hb 13,5; Plaquetas 154.000; GB 4000; neutrófilos segmentados 65%; en cayado 0%; eosinófilos 2%; linfocitos 29%; monocitos 4%.
Concentración de protrombina 94%
Tiempo de protrombina 12,6 seg
KPTT 34 seg
Na 137; K 3,9; Cl 107 meq/L
Glucemia 121 mg/dl; urea 0,32 g/L; creatinina 0,9 mg/dl
A las 72 horas siguió con fiebre y se repitió el laboratorio:
LABORATORIO 21/09/2018
GR 4.240.000; Hto 39; Hb 13,5; Plaquetas 89.000; GB 2900; neutrófilos segmentados 48%%; en cayado 0%; eosinófilos 5%; linfocitos 52%; monocitos 5%.
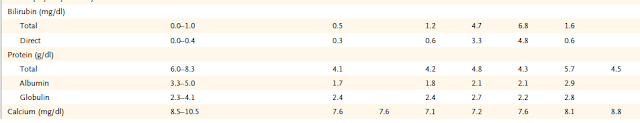
TGO: 761 mU/ml; TGP 761 mU/ml; FAL 1747 mU/ml;
LDH: 1712 mU/ml
LABORATORIO 28/09/2018
GR 4.240.000; Hto 39; Hb 13,5; Plaquetas 110.000; GB 4100; neutrófilos segmentados 33%%; en cayado 0%; eosinófilos 1%; linfocitos 62%; monocitos 4%.
TGO: 243 mU/ml; TGP 560 mU/ml; FAL 1767 mU/ml;
La bilirrubina fue siempre dentro de valores normales
Se recibieron Hemocultivos 3 muestras negativos
Serología VIH, HCV, HBV, parvovirus, CMV todos negativos.VDRL negativa.
El paciente es sometido a TC tóraco-abdómino-pélvica que no mostró alteraciones.
Al cabo de 10 días desapareció la fiebre en forma espontánea y se normalizaron los valores de laboratorio. Al cabo de tres semanas del análisis inicial para VIH que había sido negativo, se repitió un nuevo examen por la misma metodología que resultó positivo con lo que se estableció el diagnóstico retrospectivo de síndrome retroviralagudo por VIH
DIAGNÓSTICO DEEFINITIVO: INFECCIÓN AGUDA POR VIH (SÍNDROME RETROVIRAL AGUDO)
Gentileza
Dra María Herrera
Residente de Medicina General.
Hospital Municipal de Chacabuco
Buenos Aires
Argentina
INFECCIÓN AGUDA EINFECCIÓN TEMPRANA POR VIH: MANIFESTACIONES CLÍNICAS Y DIAGNÓSTICO.
INTRODUCCIÓN
La infección aguda por VIH puede presentarse como un síndrome mononucleósico con una constelación de síntomas inespecíficos. Sin un alto grado de sospecha, los médicos pueden pasar por alto con frecuencia el diagnóstico. En algunos casos, la infección temprana por VIH puede ser asintomática.
DEFINICIONES
En la literatura se han utilizado diferentes términos, incluida la infección por VIH aguda, reciente, primaria y temprana, para referirse a intervalos variables después de la infección inicial con el virus. En este tema, usamos el término "infección temprana por VIH" para referirnos al período aproximado de seis meses después de la adquisición del VIH. Utilizamos el término "infección aguda por VIH" para referirnos a una infección temprana sintomática, ya que esto refleja el uso común en la atención clínica.
CARACTERÍSTICAS CLÍNICAS
INFECCIÓN ASINTOMÁTICA
Se estima que entre el 10 y el 60 por ciento de las personas con infección temprana por VIH no experimentarán síntomas [ 1 ], aunque la proporción exacta es difícil de estimar, ya que los pacientes generalmente reciben atención debido a los síntomas y, por lo tanto, las infecciones asintomáticas a menudo no se detectan. En un estudio de 50 individuos con infección aguda que se identificaron mediante pruebas virales prospectivas de individuos de alto riesgo y luego fueron seguidos dos veces por semana, casi todos tuvieron al menos un síntoma o signo informado durante las primeras cuatro semanas de infección, pero estos fueron principalmente de corta duración, inespecíficos, y es poco probable que hayan llevado a la persona a la atención clínica fuera del entorno del estudio [ 2]. Los sujetos se quejaron de síntomas en solo el 29 por ciento de las visitas de estudio quincenales durante este período.
CURSO TEMPORAL: en pacientes con infección sintomática aguda, el tiempo habitual desde la exposición al VIH hasta el desarrollo de los síntomas es de dos a cuatro semanas, aunque se han observado periodos de incubación de hasta 10 meses [ 3 ]. En un estudio que evaluó la dinámica viral después de la infección por VIH, se observó la mayor frecuencia de síntomas y signos justo antes de que se produjera el pico de viremia, aproximadamente dos semanas después de la detección inicial del ARN viral [ 2 ]. Es posible que la ruta de adquisición y la cantidad de inóculo del virus influyan en el tiempo de pico de la viremia y en la duración del período de incubación.
La mayoría de los síntomas asociados con la infección aguda por VIH se resuelven por sí solos; sin embargo, la gravedad y la duración de los síntomas varían ampliamente de un paciente a otro.
SIGNOS Y SÍNTOMAS:
Se puede observar una variedad de síntomas y signos en asociación con la infección sintomática aguda por VIH. Esta constelación de síntomas también se conoce como el síndrome retroviral agudo. Las series publicadas informan sistemáticamente que los hallazgos más comunes son fiebre, linfadenopatía, dolor de garganta, erupción cutánea, mialgias, artralgias, diarrea, pérdida de peso y cefalea ( tabla 1 ) [ 2,4-8 ]. Ninguno de estos hallazgos es específico para la infección aguda por VIH, pero ciertas características, especialmente la duración prolongada de los síntomas y la presencia de úlceras mucocutáneas, sugieren el diagnóstico.
Tabla 1. Manifestaciones clínicas de la infección aguda por VIH.
Más allá de estos síntomas más comunes, se ha descrito una amplia gama de otros síntomas en pacientes con infección aguda o temprana por VIH. En un estudio prospectivo de 290 de estos pacientes, se consideró que 74 (26 por ciento) de los pacientes tenían presentaciones sintomáticas atípicas, incluidas infecciones oportunistas y manifestaciones del sistema nervioso central [ 7 ].
La presencia y el aumento de la gravedad y la duración de los síntomas parecen ser factores de mal pronóstico [ 9-11 ]. Como ejemplo, en un estudio de 218 trabajadoras sexuales con fechas bien documentadas de seroconversión del VIH basada en la detección longitudinal, cada síntoma adicional presente en el momento de la infección aguda se asoció con un riesgo creciente de mortalidad general después de una mediana de seguimiento de 4,6 años [ 11 ]. Es importante destacar que estos datos se recopilaron en pacientes que no tuvieron acceso a la terapia contra el VIH.
SÍNTOMAS CONSTITUCIONALES: la fiebre, la fatiga y las mialgias son los síntomas más comunes informados por los pacientes con infección aguda por VIH [ 2,9,12 ]. La fiebre en el rango de 38 a 40ºC está presente en la gran mayoría de los pacientes con infección por VIH aguda sintomática [ 5,10,13-15 ]. En un estudio de 41 pacientes, la temperatura media máxima informada fue de 38.9ºC [ 16 ].
ADENOPATÍAS: no dolorosa las linfadenopatías que afectan principalmente los ganglios axilares, cervicales, y occipital es también común. La adenopatía a menudo se desarrolla durante la segunda semana de la enfermedad, concomitante con la aparición de una respuesta inmune específica al VIH. Los ganglios disminuyen de tamaño después de la presentación aguda, pero un grado modesto de adenopatía tiende a persistir [ 15 ]. También se puede producir hepatoesplenomegalia leve [ 17 ].
HALLAZGOS OROFARÍNGEOS: el dolor de garganta es una manifestación frecuente de infección aguda por VIH. El examen físico revela edema faríngeo e hiperemia, generalmente sin agrandamiento de las amígdalas o exudado [ 18,19 ]. Sin embargo, también se ha descrito amigdalitis unilateral o bilateral [ 7 ].
La ulceración mucocutánea dolorosa es una de las manifestaciones más distintivas de la infección aguda por VIH. Úlceras fuertemente demarcadas poco profundas con bases blancas rodeadas por una zona delgada de eritema se pueden encontrar en la mucosa oral, ano, pene, o el esófago [ 20 ]. Estas lesiones ulcerativas pueden reflejar enfermedad mucocutánea asociada con infección aguda por VIH [ 15 ] o infecciones de transmisión sexual coincidentes, como el virus del herpes simple, la sífilis o el chancroide [ 21 ]. En un estudio de 10 hombres que tienen sexo con hombres (HSH) con infección aguda por VIH y ulceración mucocutánea limitada a una ubicación, las lesiones se produjeron en un sitio involucrado en la actividad sexual en el momento de la transmisión probable.
En otro estudio de 16 hombres con infección aguda por VIH y odinofagia, la endoscopia demostró úlceras esofágicas de 0,3 a 1,5 cm de diámetro en todos los pacientes [ 22 ]. El tejido obtenido de estas úlceras en ocho de los sujetos reveló partículas de virus por microscopía electrónica que eran morfológicamente compatibles con el VIH; en un paciente se cultivó el VIH a partir de la lesión.
ERUPCIÓN: una erupción generalizada también es un hallazgo común en la infección aguda por VIH sintomática. La erupción suele ocurrir de 48 a 72 horas después del inicio de la fiebre y persiste durante cinco a ocho días. El tórax superior, la región del cuello y la cara son los más afectados, aunque el cuero cabelludo y las extremidades, incluidas las palmas y las plantas de los pies, pueden verse afectadas. Las lesiones son característicamente pequeñas (5 a 10 mm), bien circunscritas, ovaladas o redondas, de color rosado a rojo intenso o máculas o maculopápulas [ 20 ]. También se han informado erupciones vesiculares, pustulosas y urticarianas [ 19,23 ], pero no son tan comunes como una erupción maculopapular. El prurito es inusual y solo leve cuando está presente.
Los hallazgos histopatológicos son inespecíficos en las lesiones cutáneas, y la biopsia de una lesión cutánea generalmente no ayuda en el diagnóstico de la infección aguda por VIH. La epidermis es normal y la dermis contiene un infiltrado linfocítico escaso, principalmente alrededor de los vasos del plexo superficial [ 17 ].
SÍNTOMAS GASTROINTESTINALES: dado que el tracto gastrointestinal es un objetivo principal durante la infección aguda, los pacientes con infección aguda por VIH a menudo se quejan de náuseas, diarrea, anorexia y pérdida de peso, con un promedio de 5 kg. Las manifestaciones gastrointestinales más graves son raras e incluyen pancreatitis y hepatitis [ 24,25 ].
HALLAZGOS NEUROLÓGICOS: el dolor de cabeza, a menudo descrito como dolor retroorbitario exacerbado por el movimiento ocular, frecuentemente acompaña a la infección aguda por VIH. También se han notificado manifestaciones neurológicas más graves de la infección aguda por VIH, pero son inusuales [7, 26 ].
El primer síndrome neurológico grave que se reconoció fue la meningitis aséptica, con cefalea severa, meningismo, fotofobia y pleocitosis linfocítica en el análisis del líquido cefalorraquídeo (LCR) [ 27,28 ]. En un estudio de 41 pacientes con infección aguda por VIH sintomática, 10 (24 por ciento) tenían síntomas y signos que sugerían meningitis aséptica [ 16 ]. El VIH se cultivó a partir del LCR en 12 de los 24 pacientes que aceptaron someterse a una punción lumbar (una mediana de 51 días después de la seroconversión del VIH).
En raras ocasiones, una encefalopatía autolimitada puede acompañar una infección aguda por VIH. Un informe describió a dos pacientes con fiebre, cambios pronunciados de personalidad, confusión y, en un caso, convulsiones tónicas / clónicas , asociadas con la seroconversión al VIH [ 29 ]. Otro informe describió a un paciente con infección aguda con signos tanto de encefalopatía como de mielopatía, incluida la espasticidad de la extremidad inferior, los reflejos plantares del extensor bilateral y la retención de orina, que progresó a la espasticidad y debilidad de la extremidad superior [ 30 ].
El sistema nervioso periférico también puede verse afectado por la infección aguda por VIH. Como ejemplo, un informe describe dos casos de síndrome de Guillain-Barré que ocurren 1 y 20 semanas después del VIH agudo sintomático [ 31 ]. El nervio facial y las parálisis braquiales también se han observado [ 23,32,33 ].
OTROS: aparte de las quejas de tos seca, las manifestaciones pulmonares son poco frecuentes durante la infección aguda por VIH. Se han notificado casos raros de neumonitis en este contexto, que se manifiestan como tos, disnea e hipoxia sin evidencia de otras etiologías infecciosas [ 34,35 ]. Dos de estos pacientes tenían marcas intersticiales aumentadas en la radiografía de tórax. El lavado broncoalveolar se realizó en un paciente y reveló un predominio de linfocitos CD8 +.
La rabdomiolisis aguda y la vasculitis son otras manifestaciones inusuales [ 36,37 ].
INFECCIONES OPORTUNISTAS: aunque por lo general se asocian con enfermedad del VIH en etapa tardía, las infecciones oportunistas rara vez pueden ocurrir durante la linfopenia transitoria de CD4 de la infección temprana por VIH [ 38 ]. En un estudio de 290 pacientes diagnosticados de infección aguda o temprana por VIH en un solo centro durante 10 años, 21 presentaron una enfermedad oportunista [ 7 ].
La candidiasis oral y esofágica es la infección oportunista más frecuente en estos pacientes [ 7,39,40 ]. Los factores responsables de la frecuencia de la candidiasis esofágica durante la inmunosupresión de la infección aguda por VIH no se conocen bien [ 41 ]. Dos posibilidades son que la ulceración esofágica proporciona un entorno local que promueve el crecimiento de las especies de Candida y que la administración de antibióticos para tratar empíricamente los síntomas del VIH agudo puede alterar la flora orofaríngea normal.
Otras infecciones oportunistas que se han reportado durante la infección aguda por VIH incluyen la infección por CMV (proctitis, colitis y hepatitis) [ 7,25 ], neumonía por Pneumocystis jirovecii [ 42 ] y criptosporidiosis severa y prolongada [ 43 ].
CARACTERÍSTICAS DEL LABORATORIO: en la infección temprana por VIH, que es un período de rápida replicación viral e infección de células T CD4, el nivel de ARN viral suele ser muy alto (por ejemplo,> 100,000 copias / ml) y el recuento de células CD4 puede disminuir de forma transitoria.
Como ejemplo, en un estudio de 50 individuos con infección aguda, la mediana del nivel viral máximo fue de aproximadamente 5 millones de copias / ml y se produjo a una mediana de 13 días (rango de 6 a 18) después de la detección inicial del ARN viral [ 2 ]. Posteriormente, la carga viral se redujo a una mediana de 30,000 copias / ml entre 18 y 42 días después de la detección de ARN y permaneció generalmente estable dentro de un registro durante el año siguiente.
El recuento de leucocitos y los subconjuntos de linfocitos varían durante la enfermedad aguda. Inicialmente, hay una caída en el recuento total de glóbulos blancos. En un estudio, por ejemplo, el recuento de leucocitos se redujo a 960 / microL nueve días después del inicio de los síntomas [ 44 ]. Los recuentos de células CD4 disminuyen en relación con el aumento de la carga viral, y los recuentos de células CD8 aumentan. Tras la viremia máxima, los recuentos de células CD4 rebotan y los recuentos de células CD8 disminuyen, pero generalmente no vuelven a los niveles de referencia. Los niveles de células CD8 permanecen más altos que los niveles de células CD4, lo que resulta en una inversión persistente de la proporción normal de CD4: CD8 a menos de 1 [ 44]]. Se pueden observar linfocitos atípicos durante esta última fase, aunque con una frecuencia e intensidad significativamente menores que en el síndrome de mononucleosis clásica causado por el virus de Epstein-Barr (VEB) (menos de 50 por ciento versus 90 por ciento de los casos).
Una prueba positiva de anticuerpos heterófilos también se ha informado de forma poco frecuente durante el VIH agudo [ 15,17,19 ]; no está claro si esto representa una prueba positiva falsa o la reactivación del VEB durante el VIH agudo [ 45 ]. Independientemente de la causa, la importancia de este hallazgo es que una prueba de anticuerpos heterófilos positivos no excluye el diagnóstico de infección aguda por VIH.
Además, los aumentos de las enzimas hepáticas, la anemia leve y la trombocitopenia se han reportado en asociación con la infección temprana por VIH.
DIAGNÓSTICO DIFERENCIAL: el diagnóstico diferencial de la infección aguda por VIH incluye la mononucleosis debida al virus de Epstein-Barr (EBV) o citomegalovirus (CMV), toxoplasmosis, rubéola, sífilis, infección gonocócica diseminada, hepatitis viral y otras infecciones virales. Ciertas características de las nuevas enfermedades autoinmunes también pueden parecerse al síndrome retroviral agudo. Varios hallazgos clínicos ayudan a distinguir estos trastornos del VIH agudo:
- La ulceración mucocutánea es inusual en estas otras infecciones con la excepción de la sífilis y, si existe, debe aumentar la sospecha de VIH agudo.
- La erupción no es común en la mononucleosis por VEB (a menos que se hayan administrado antibióticos), la mononucleosis por CMV y la toxoplasmosis, y tiende a respetar las palmas y las plantas en la rubéola. La erupción de la infección aguda por VIH puede parecerse a la pitiriasis rosada, pero los síntomas constitucionales marcados son inusuales en la pitiriasis [ 19 ].
- La aparición repentina de síntomas, el edema faríngeo con poco exudado amigdalino asociado o hipertrofia, y diarrea, que se puede observar en el VIH agudo, son características que ayudan a distinguirla de la mononucleosis por EBV. Tanto la linfocitosis atípica como una prueba de anticuerpos heterófilos positivos pueden ocurrir en el contexto del VIH agudo; por lo tanto, estos hallazgos no excluyen la posibilidad del VIH. Sin embargo, el número de linfocitos atípicos presentes es generalmente mayor en el EBV que en el VIH.
- El lupus eritematoso sistémico (LES) puede parecerse mucho a la infección aguda por VIH. Sin embargo, el LES se distingue por la presencia de anticuerpos antinucleares.
También se han observado síntomas asociados con el síndrome retroviral agudo en pacientes con infección crónica por VIH que suspendieron la terapia antirretroviral efectiva [ 46,47 ]. En estos informes de casos, los síntomas que incluyen fiebre, linfadenopatía y erupción cutánea se desarrollaron en cuatro pacientes de 10 días a cuatro semanas después de descontinuar todos los medicamentos antirretrovirales. Los niveles virales de VIH, que habían sido menos de 50 copias / ml en todos los pacientes, aumentaron drásticamente hasta 1.000.000 copias / ml, y los recuentos de CD4 disminuyeron considerablemente. También se han notificado casos de VIH agudo sintomático recrudescente en pacientes tratados durante una infección aguda que han interrumpido el tratamiento [ 48]. Estas situaciones se distinguen fácilmente del síndrome retroviral agudo de infección aguda por VIH en la historia.
DIAGNÓSTICO: el diagnóstico de infección aguda o temprana por VIH se establece mediante la detección de viremia por VIH en el contexto de un patrón de prueba de VIH particular ( inmunoensayo de screening negativo O una combinación de anticuerpos / antígeno inmunoensayo positivo con un inmunoensayo de anticuerpos solo negativo). Sin embargo, debido a la creciente sensibilidad de los inmunoensayos disponibles, una persona con infección aguda o temprana por VIH (es decir, infectada en los seis meses anteriores) ya puede tener inmunoensayos reactivos (combinación de anticuerpo como el antígeno y el inmunoensayo de anticuerpos) además de la viremia detectable. En tales casos, el momento de la infección, y por lo tanto el diagnóstico de infección aguda o temprana versus infección establecida, debe inferirse de la presentación clínica (por ejemplo, síntomas compatibles con el síndrome retroviral agudo en la presentación o reconocidos en retrospectiva o un nivel muy alto de ARN viral) , historial de exposición y cualquier prueba serológica pasada disponible.
Cuando se considera la posibilidad de una infección por VIH aguda o temprana en función de la sospecha clínica, realizamos el inmunoensayo más sensible disponible (idealmente, una combinación de inmunoensayo antígeno / anticuerpos ) además de una prueba de carga viral.
Debido a la creciente disponibilidad de las pruebas de detección del VIH que acortan significativamente el tiempo desde la adquisición del VIH hasta una prueba positiva y las recomendaciones para usar algoritmos de detección específicos que son más sensibles a la infección temprana [ 49 ], se diagnostican más pacientes con VIH agudo o temprano.
Debido a los datos cada vez mayores que respaldan los beneficios de salud pública e individual para la terapia antirretroviral durante la infección aguda y temprana en lugar de más adelante en el curso de la enfermedad, los pacientes recién diagnosticados deben ser referidos de inmediato a un especialista apropiado para revisar las opciones de tratamiento.
SOSPECHA CLÍNICA: dada la amplia gama de síntomas asociados con la infección aguda por VIH, los médicos deben tener un umbral bajo para sospecharla. En particular, se debe considerar la posibilidad de una infección aguda por VIH en pacientes que presenten los signos y síntomas más típicos, que incluyen una enfermedad febril mal definida, síndrome similar a la mononucleosis heterófila negativa, mononucleosis positiva heterófila en un huésped inusual (por ejemplo, , un paciente adulto mayor), y / o meningitis aséptica. Ciertas características clínicas, como erupción cutánea, úlceras mucocutáneas, diarrea o linfadenopatía, deberían aumentar la sospecha de infección por VIH.
Si bien todos los pacientes deben ser interrogados sobre los comportamientos de riesgo del VIH, incluida la actividad sexual y el uso de drogas inyectables, los pacientes pueden ser reacios a divulgar esta información o pueden no percibir su comportamiento como de alto riesgo. Como ejemplo, hemos visto a varios hombres que contrajeron el VIH a través del sexo oral receptivo y expresaron sorpresa de que este fuera un modo de transmisión del VIH. Por lo tanto, la ausencia de factores de riesgo provocados no debe excluir la posibilidad de una infección por VIH.
La infección temprana por VIH también debe considerarse en pacientes que han tenido una exposición reciente de alto riesgo o en aquellos que han tenido una infección reciente de transmisión sexual (en particular sífilis), independientemente de la presencia de síntomas o signos. Ciertos pacientes que han tenido una exposición de alto riesgo muy reciente (es decir, dentro de las 72 horas) pueden ser candidatos para la profilaxis posterior a la exposición (PEP) contra el VIH.
ALGORITMO DE DIAGNÓSTICO: cuando se considera la posibilidad de una infección aguda o temprana por VIH, realizamos el inmunoensayo de detección más sensible disponible (idealmente, una combinación de Inmunoensayo antígeno / anticuerpos ) además de una prueba virológica de VIH (carga viral). Estamos a favor de usar una prueba de carga viral basada en RT-PCR, si está disponible. Una prueba virológica de VIH positiva es generalmente indicativa de infección por VIH. El momento aproximado de la infección (es decir, temprana versus establecida) se puede evaluar por el patrón de reactividad del inmunoensayo y la presentación clínica ( tabla 2 ):
Tabla 2 Timing en la positividad de los tests utilizados en el diagnóstico de la infección
- Un inmunoensayo de detección de VIH negativo y una prueba virológica negativa sugieren fuertemente que no se ha adquirido la infección por VIH. En el caso de exposiciones muy recientes de alto riesgo, cuando la transmisión del VIH sigue siendo un problema, es necesario repetir las pruebas en una o dos semanas (especialmente si se presentan síntomas de VIH agudo).
- Un inmunoensayo de detección de VIH negativo y una prueba virológica positiva sugieren una infección temprana por VIH. Sin embargo, en esta situación, un nivel de ARN menos de 1000 copias / ml puede representar raramente una prueba viral positiva falsa y la prueba de carga viral debe repetirse inmediatamente en una nueva muestra de sangre. Una segunda prueba virológica positiva sugiere una infección por VIH, que puede confirmar una prueba serológica repetida varias semanas después para evaluar la seroconversión.
- Se puede observar un inmunoensayo de detección de VIH positivo y una prueba virológica positiva en la infección por VIH temprana o establecida. Un inmunoensayo de detección positivo debe provocar un segundo inmunoensayo de solo anticuerpo (preferiblemente el VIH-1 / VIH-2).inmunoensayo de diferenciación) si aún no se ha realizado. Un resultado negativo en esta segunda prueba con una prueba virológica positiva apoya el diagnóstico de infección aguda por VIH. Sin embargo, un resultado positivo en el segundo inmunoensayo no excluye la posibilidad de infección reciente y seroconversión. En tales casos, la distinción entre infección temprana y establecida debe inferirse a partir de la presentación clínica (por ejemplo, síntomas compatibles con el síndrome retroviral agudo en la presentación o reconocidos en retrospectiva o un nivel muy alto de ARN viral), historial de exposición y cualquier prueba serológica anterior disponible. (por ejemplo, una prueba serológica negativa dentro de los seis meses anteriores).
Si el diagnóstico de infección por VIH aguda o temprana se basó en una prueba virológica positiva única en el contexto de un inmunoensayo de VIH negativo, es apropiado confirmar el diagnóstico de VIH agudo o temprano con una segunda prueba. Esto puede ser una prueba serológica repetida de ARN del VIH en varias semanas para documentar la seroconversión. Si se inicia el tratamiento, no es necesario esperar las pruebas de confirmación a menos que el diagnóstico inicial sea incierto.
Este algoritmo de diagnóstico para la sospecha de infección aguda por VIH es distinto de los algoritmos generales de detección que incluyen un inmunoensayo seguido de un inmunoensayo de confirmación de un segundo tipo si el primero es positivo, con pruebas de ARN del VIH reservadas para resultados discrepantes entre los dos inmunoensayos. La principal diferencia es el uso de la prueba virológica al mismo tiempo que el inmunoensayo de detección.
DETECCIÓN DE LA INFECCIÓN TEMPRANA A TRAVÉS DE LA DETECCIÓN DE RUTINA: dado que muchas pautas ahora recomiendan la detección universal de la infección por VIH, se pueden hacer nuevos diagnósticos de VIH, incluidos los de infección temprana, entre pacientes en los que no se sospechó inicialmente la infección por VIH.
En los Estados Unidos, el algoritmo recomendado para la detección consiste en un inmunoensayo de antígeno / anticuerpo combinado de cuarta generación inicial con un inmunoensayo de diferenciación de VIH-1 / VIH-2 confirmatorio solo de anticuerpos seguido de pruebas virales de VIH si hay una discrepancia ( algoritmo 1 ) [ 49 ]. En este algoritmo, el VIH agudo o temprano se diagnostica cuando el inmunoensayo inicial es reactivo, el segundo inmunoensayo no es reactivo y la prueba viral detecta el ARN del VIH repetidamente o en un nivel alto.
Algoritmo 1
Este algoritmo es más sensible para detectar la infección por VIH aguda y temprana que el algoritmo anterior, que involucró el seguimiento de un inmunoensayo de detección reactiva con una prueba de Western blot. Como ejemplo, en un estudio de 99 pacientes que tenían un anticuerpo de combinación reactiva e inmunoensayo de antígenos en el cribado seguido de un segundo inmunoensayo no reactivo, la prueba de ARN fue positiva en 55 individuos, lo que permitió diagnosticar una infección temprana [ 50 ]. De estos pacientes con infección temprana, 27 también se sometieron a una prueba de Western blot, de los cuales 15 (56 por ciento) tuvieron una prueba negativa y, por lo tanto, pueden haber pasado por alto diagnósticos.
Es de destacar que, si bien este algoritmo es más probable que detecte algunos casos de infección temprana por VIH durante el examen de rutina, si se sospecha una infección aguda o temprana por VIH (por ejemplo, en función de la presencia de síntomas o exposiciones recientes), seguimos favoreciendo la realización de una prueba sensible. Inmunoensayo y test virológico al mismo tiempo.
Algunos laboratorios aún pueden emplear pruebas de Western blot para confirmar un inmunoensayo reactivo inicial. Detectar el VIH temprano con este algoritmo requiere verificar una prueba de ARN viral si la transferencia de Western es negativa o indeterminada. En tales casos, un inmunoensayo reactivo seguido de un Western blot negativo o indeterminado seguido de una prueba de ARN viral positivo es muy probablemente indicativo de una infección temprana por VIH. Por lo tanto, un inmunoensayo reactivo seguido de un Western blot negativo o indeterminado no debe interpretarse erróneamente como un patrón de cribado negativo para el VIH sin pruebas adicionales.
RELEVANCIA CLÍNICA DE LA DETECCIÓN TEMPRANA: el diagnóstico de VIH agudo es importante, ya que el rápido inicio de la terapia antirretroviral reduce la probabilidad de transmisión del VIH a otros y puede reducir el tamaño del reservorio de VIH latente, lo que potencialmente hace que los pacientes sean elegibles para futuras estrategias de erradicación del VIH. El tratamiento anti-retroviral (TAR) temprano también puede mejorar los síntomas relacionados con la infección aguda por VIH. Esto se discute en detalle en otra parte.
Consideraciones para poblaciones específicas.
Exposición muy reciente: la viremia detectable no se desarrolla hasta aproximadamente 10 a 15 días después de la infección, e incluso los inmunoensayos más sensibles no se vuelven positivos hasta cinco días después de eso ( tabla 2 ). Por lo tanto, si la exposición ocurrió durante esta ventana, el diagnóstico de la infección por VIH puede pasarse por alto. Si el inmunoensayo inicial y las pruebas virológicas son negativos y la sospecha clínica de una exposición reciente al VIH es alta, repetimos las pruebas una o dos semanas después.
ESTUDIOS SEROLÓGICOS: después de la infección con el VIH, el momento en que se pueden detectar los anticuerpos contra los antígenos del VIH en el suero depende de la sensibilidad de la prueba serológica ( tabla 2 ). Por lo tanto, dependiendo del tiempo transcurrido desde la infección y la sensibilidad de la prueba de inmunoensayo utilizada, los pacientes con infección aguda o temprana por VIH pueden tener un inmunoensayo negativo o reactivo.
El tratamiento muy temprano para la infección aguda por VIH puede conducir a la anulación de las respuestas de anticuerpos del VIH [ 67,68 ]. Como ejemplo, en un estudio de 150 pacientes con infección aguda por VIH tratados con terapia antirretroviral (TAR), tres pacientes no desarrollaron una respuesta de anticuerpos completamente evolucionada y / o demostraron evidencia de serorreversión después de la supresión exitosa del ARN del VIH [ 67 ]. Se ha postulado que la maduración de la respuesta de los anticuerpos puede verse frustrada por la rápida supresión del ARN del VIH en una etapa temprana de la enfermedad [ 69 ]. Es fundamental que los clínicos y los pacientes entiendan que la serorreversión no indica erradicación viral [ 68,70 ].
EVALUACIÓN ADICIONAL
Pruebas de resistencia a los medicamentos: para todos los pacientes con infección temprana por VIH, se deben realizar pruebas de resistencia a los medicamentos después de que se haya establecido el diagnóstico inicial, independientemente de si se está considerando el tratamiento [ 1,71 ]. En estudios de pacientes con infección aguda y temprana por VIH, alrededor del 15 al 20 por ciento de los pacientes se infectaron con un aislado que al menos albergaba una mutación de resistencia al fármaco [ 72-74 ]. La presencia de mutaciones en las cepas transmitidas está fuertemente influenciada por los patrones de uso de fármacos antirretrovirales en la fuente. Las mutaciones que confieren resistencia a los inhibidores de la transcriptasa inversa no nucleósidos son más comunes que las mutaciones de resistencia a los inhibidores de la proteasa.
En este contexto, se prefieren las pruebas de resistencia de genotipo a las pruebas de fenotipo debido a su costo más bajo, el tiempo de respuesta más rápido (aproximadamente una a tres o cuatro semanas) y su mayor sensibilidad para mezclas de virus resistentes y de tipo salvaje. La interpretación de los resultados de las pruebas de resistencia se discute en detalle en otra parte.
Si finalmente se decide el inicio de la terapia contra el VIH, la selección de los regímenes de tratamiento debe tener en cuenta estas mutaciones de resistencia detectadas inicialmente. La determinación del perfil de resistencia farmacológica del paciente poco después de la infección es importante, ya que algunas mutaciones de resistencia pueden volverse indetectables con el tiempo sin la presión de selección de la terapia antirretroviral. Como ejemplo, en un estudio de hombres recientemente infectados con VIH que albergaban mutaciones que confirieron resistencia contra los inhibidores de la transcriptasa inversa no nucleósidos, se observó que los dos hombres seguidos más de un año experimentaron una reversión de mutaciones al virus de tipo salvaje después de 2.5 a 3,5 años [ 75]. Además, a pesar de la pérdida de mutaciones de resistencia a los medicamentos en virus circulantes, las mutaciones de resistencia aún se detectaron en el virus presente en el semen.
DETECCIÓN DE COINFECCIONES Y EXPOSICIONES PREVIAS: todos los pacientes con infección por VIH recién diagnosticada también deben someterse a pruebas para detectar otras infecciones de transmisión sexual.
La evaluación de la exposición a otras infecciones crónicas, como se realiza en pacientes diagnosticados con infección crónica por VIH, también está indicada para establecer el riesgo de una posible reactivación futura o la necesidad de vacunación.
IMPLICACIONES DE SALUD PÚBLICA: establecer el diagnóstico de infección temprana por VIH es claramente importante desde la perspectiva de la salud pública. Los pacientes suelen ser muy infecciosos durante el VIH temprano debido a una enorme carga viral en la sangre y en las secreciones genitales (con un rango general de niveles de ARN en suero de 100,000 a más de un millón de copias / mL en comparación con 30,000 a 50,000 copias / mL en infecciones crónicas sin tratamiento) ) [ 76-78]. Además, estos pacientes pueden desconocer que están infectados y seguir participando en actividades sexuales de riesgo y compartiendo agujas, poniendo a otros en riesgo. En un análisis de hombres recientemente infectados que tienen sexo con hombres (HSH), la tasa de transmisión durante la infección temprana fue de 9 a 15 veces mayor que el riesgo de transmisión durante la infección crónica [ 79 ]. Del mismo modo, en algunos entornos, se estima que la transmisión de individuos con infección aguda representa la mayoría de las nuevas infecciones por VIH [ 80-82 ]. Las mujeres embarazadas que desconocen su infección aguda pueden transmitir el VIH perinatalmente a menos que se haga un diagnóstico oportuno y se inicie la terapia antirretroviral [ 83 ].
Sin embargo, el diagnóstico de infección aguda o temprana por VIH se realiza con poca frecuencia en la práctica clínica. En una serie de casos de Seattle, por ejemplo, el diagnóstico de infección por VIH se consideró en solo 5 de 19 pacientes (26 por ciento) con síndrome retroviral agudo que buscaban atención de sus médicos de atención primaria, servicios de urgencias y clínicas ambulatorias [ 16] ]. Este hallazgo fue especialmente sorprendente ya que estos pacientes se inscribieron en un programa de vigilancia para el VIH.
Hay varias razones por las que la infección por VIH aguda y temprana se diagnostica con poca frecuencia:
● Los síntomas, especialmente en casos leves, no son específicos y se resuelven espontáneamente sin tratamiento. Además, muchos pacientes pueden ser asintomáticos. (Ver "Características clínicas" más arriba.)
● Es posible que los médicos no se sientan cómodos haciendo preguntas sobre la exposición sexual o el uso de drogas por vía intravenosa, especialmente con pacientes a los que ven con poca frecuencia, como individuos jóvenes previamente sanos.
● Es posible que los médicos de atención primaria no estén al tanto de las conductas de alto riesgo, incluso en pacientes que conocen bien. Dichos pacientes a menudo eligen someterse a asesoramiento y pruebas serológicas en serie en una clínica anónima en lugar de discutir conductas de riesgo con su proveedor de atención primaria.
● Los pacientes pueden no percibirse a sí mismos en riesgo.
● Los clínicos y los pacientes pueden asumir la validez continua de una prueba de VIH previamente negativa, incluso en pacientes de alto riesgo.
Estos problemas resaltan la importancia de mantener un alto grado de sospecha al considerar la posibilidad de una infección aguda por VIH en pacientes con enfermedades febriles mal definidas, independientemente de los factores de riesgo aparentes. (Ver 'Sospecha clínica' arriba).
Se debe aconsejar a todos los pacientes con infección aguda o temprana de VIH sospechada o confirmada que adopten conductas que protejan contra la transmisión del VIH, incluido el uso consistente y correcto del condón y evitar compartir el equipo de uso de drogas inyectables.
INFECCIÓN AGUDA Y TEMPRANA POR VIH: TRATAMIENTO
DECISIÓN PARA INICIAR LA TERAPIA ANTIRETROVIRAL DURANTE LA INFECCIÓN TEMPRANA POR VIH - Para pacientes con VIH con infección crónica, un creciente cuerpo de evidencia de ensayos y grandes estudios observacionales que demuestran una reducción de la morbilidad y mortalidad por SIDA y por no SIDA con terapia antirretroviral (ART) en un amplio rango de los recuentos de células CD4 ha llevado a la recomendación de muchos expertos para la iniciación de ART, independientemente del recuento de células CD4.
Sin embargo, debido a las dificultades para identificar a los pacientes con infección temprana, hay menos datos claros sobre los beneficios clínicos a largo plazo de iniciar el tratamiento durante esta etapa de la infección por VIH. Por lo tanto, la mayor parte de las razones para iniciar el tratamiento en la infección temprana por VIH se extrapola de la evidencia indirecta, los beneficios teóricos y los efectos del tratamiento antirretroviral en los marcadores de la progresión de la enfermedad del VIH (es decir, el recuento de células CD4 y el ARN del VIH). La decisión de iniciar la terapia antirretroviral en la infección temprana debe equilibrar estos beneficios potenciales con los riesgos potenciales de la terapia antirretroviral.
JUSTIFICACIÓN PARA EL INICIO DEL TRATAMIENTO ANTIRRETROVIRAL EN LA INFECCIÓN TEMPRANA
EFECTO SOBRE LA ENFERMEDAD SINTOMÁTICA: la presencia y la gravedad de los síntomas durante la infección temprana por VIH parecen indicar una progresión más rápida de la enfermedad [ 3-5 ]. Como ejemplo, en un estudio de 218 trabajadoras sexuales con fechas bien documentadas de seroconversión del VIH basada en la detección longitudinal, en ausencia de tratamiento contra el VIH, cada síntoma adicional presente en el momento de la infección aguda se asoció con un riesgo mayor de riesgo general. Mortalidad después de una mediana de seguimiento de 4,6 años [ 86 ]. Por lo tanto, aquellos con infección sintomática aguda por VIH pueden representar un subgrupo de pacientes en los que el inicio temprano de la terapia antirretroviral tendría más probabilidades de conferir una mejora en la morbilidad y la mortalidad que, por lo tanto, superaría los riesgos potenciales.
Además, dado que se piensa que los síntomas de la infección aguda por VIH están relacionados con el alto nivel de virus circulante, ya sea por efecto directo o indirectamente a través de la respuesta inmune a la infección viral, el tratamiento temprano con ART, a través de la rápida reducción del nivel de ARN del VIH, puede ser capaz de atenuar la severidad de los síntomas. Sin embargo, no hay datos clínicos que demuestren claramente este efecto teórico.
MEJORAMIENTO DE LOS MARCADORES CLÍNICOS DE LA ENFERMEDAD: al igual que en la infección crónica, el tratamiento antirretroviral es eficaz para suprimir los niveles séricos de ARN viral y aumentar los recuentos de células CD4 en la gran mayoría de los pacientes con infección aguda y temprana por VIH. Como ejemplo, en un estudio longitudinal prospectivo de 102 pacientes infectados con VIH dentro de los 12 meses anteriores que iniciaron el tratamiento antirretroviral, el 97 por ciento logró niveles virales indetectables en una mediana de 11 semanas, y 66 de 72 pacientes (92 por ciento) mantuvieron la supresión virológica en 18 meses [ 6 ]. El recuento de células CD4 aumentó de un nadir promedio de 422 células / microL a una media de 702 células / microL .
Además, el inicio de la terapia antirretroviral más temprano después de la infección inicial por VIH se asocia con una mayor probabilidad de reconstitución inmune a niveles normales o casi normales de células CD4. En un estudio prospectivo de hombres predominantemente blancos con una fecha bien estimada de infección por VIH, se observó un pico en el recuento de células CD4 a los cuatro meses después de la infección, seguido de una disminución progresiva en ausencia de TAR. Entre los 97 pacientes que iniciaron la terapia antirretroviral en ese lapso de cuatro meses, la probabilidad y la tasa de recuperación del recuento de células CD4 fueron mayores en comparación con los 116 pacientes que iniciaron la terapia antirretroviral más tarde (64 en comparación con el 34 por ciento logró un recuento de células CD4> 900 células / microLa los 48 meses de tratamiento antirretroviral y a una mediana de 3.8 versus 15.2 meses después del inicio del tratamiento antirretroviral, respectivamente) La recuperación del recuento de células CD4 a este umbral también fue más probable y rápida en los pacientes que iniciaron la terapia con un recuento de células CD4 de referencia superior a 500 células / microL frente a menos de 500 células / microL . Aunque los pacientes tratados dentro de los cuatro meses de la infección tenían un promedio más alto de recuentos de células CD4 al inicio que los tratados más tarde, en el análisis multivariado, el inicio de la terapia antirretroviral más temprano y con un mayor recuento de células CD4 seguían siendo predictores independientes de la recuperación del recuento de células CD4.
Como el intervalo que sigue a la infección inicial hasta que el recuento de células CD4 se reduce a un umbral en el que existe evidencia clínica de que existe beneficio con TAR es relativamente corto. Por lo tanto, es probable que los pacientes con VIH temprano que inician la terapia no tengan un exceso significativo de la exposición al TARV en comparación con la terapia diferida. Esto puede mejorar las preocupaciones sobre el posible riesgo de toxicidad adicional por un mayor tiempo en la terapia antirretroviral.
La infección temprana por VIH se asocia con altos niveles de ARN del VIH y un alto riesgo correspondiente de transmisión viral. La reducción de este riesgo de transmisión a través de la supresión viral es un beneficio teórico pero plausible para el inicio temprano de ART.
Para pacientes con infección aguda por VIH, recomendamos el inicio rápido de la terapia antirretroviral ( Grado 1B ). Los beneficios potenciales de la terapia antirretroviral anterior superan los riesgos potenciales de una mayor exposición a la toxicidad de la terapia antirretroviral y la aparición de resistencia viral en el contexto de una adherencia subóptima. En particular, nos sentimos más convencidos acerca del inicio del tratamiento en pacientes con infección aguda sintomática dada la asociación entre la enfermedad sintomática y la progresión más rápida de la enfermedad.
La elección definitiva del régimen antirretroviral debe guiarse por los resultados de las pruebas de resistencia a los medicamentos, ya que la transmisión del virus que alberga al menos una mutación de resistencia no es infrecuente. Sin embargo, el tratamiento no tiene que retrasarse mientras se esperan los resultados de las pruebas de resistencia. Mientras se esperan los resultados de las pruebas de resistencia, sugerimos un régimen inicial que incluya darunavir reforzado con ritonavir ( Grado 2C ). Una vez iniciado, el tratamiento se continúa indefinidamente.
Los estudios que evalúan los efectos de un curso discreto de tratamiento antirretroviral temprano en la infección por VIH sugieren una mejora en los marcadores sustitutos de la enfermedad del VIH con una terapia temprana versus tardía, pero no está clara la durabilidad de estos beneficios después de la interrupción de la terapia antirretroviral. En contraste, la evidencia sustancial de ensayos clínicos en infecciones crónicas demuestra un aumento de la morbilidad y la mortalidad relacionadas con el SIDA y no relacionadas con el SIDA con la interrupción del tratamiento. Por lo tanto, recomendamos no utilizar una estrategia de interrupción del tratamiento en pacientes con infección aguda o temprana por VIH ( Grado 1A ).
REFERENCIAS
1) Panel on Antiretroviral Guidelines for Adults and Adolescents. Guidelines for the use of antiretroviral agents in HIV-1-infected adults and adolescents. Department of Health and Human Services. Available at http://aidsinfo.nih.gov/contentfiles/lvguidelines/AdultandAdolescentGL.pdf (Accessed on May 01, 2014).
2) Robb ML, Eller LA, Kibuuka H, et al. Prospective Study of Acute HIV-1 Infection in Adults in East Africa and Thailand. N Engl J Med 2016; 374:2120.
3) Ridzon R, Gallagher K, Ciesielski C, et al. Simultaneous transmission of human immunodeficiency virus and hepatitis C virus from a needle-stick injury. N Engl J Med 1997; 336:919.
4) Kared H, Lelièvre JD, Donkova-Petrini V, et al. HIV-specific regulatory T cells are associated with higher CD4 cell counts in primary infection. AIDS 2008; 22:2451.
5) Niu MT, Stein DS, Schnittman SM. Primary human immunodeficiency virus type 1 infection: review of pathogenesis and early treatment intervention in humans and animal retrovirus infections. J Infect Dis 1993; 168:1490.
6) Daar ES, Little S, Pitt J, et al. Diagnosis of primary HIV-1 infection. Los Angeles County Primary HIV Infection Recruitment Network. Ann Intern Med 2001; 134:25.
7) Braun DL, Kouyos RD, Balmer B, et al. Frequency and Spectrum of Unexpected Clinical Manifestations of Primary HIV-1 Infection. Clin Infect Dis 2015; 61:1013.
8) Crowell TA, Colby DJ, Pinyakorn S, et al. Acute Retroviral Syndrome Is Associated With High Viral Burden, CD4 Depletion, and Immune Activation in Systemic and Tissue Compartments. Clin Infect Dis 2018; 66:1540.
9) Daar ES, Pilcher CD, Hecht FM. Clinical presentation and diagnosis of primary HIV-1 infection. Curr Opin HIV AIDS 2008; 3:10.
10) Kelley CF, Barbour JD, Hecht FM. The relation between symptoms, viral load, and viral load set point in primary HIV infection. J Acquir Immune Defic Syndr 2007; 45:445.
11) Lavreys L, Baeten JM, Chohan V, et al. Higher set point plasma viral load and more-severe acute HIV type 1 (HIV-1) illness predict mortality among high-risk HIV-1-infected African women. Clin Infect Dis 2006; 42:1333.
12) McKellar MS, Cope AB, Gay CL, et al. Acute HIV-1 infection in the Southeastern United States: a cohort study. AIDS Res Hum Retroviruses 2013; 29:121.
13) Quinn TC. Acute primary HIV infection. JAMA 1997; 278:58.
14) Pedersen C, Lindhardt BO, Jensen BL, et al. Clinical course of primary HIV infection: consequences for subsequent course of infection. BMJ 1989; 299:154.
15) Gaines H, von Sydow M, Pehrson PO, Lundbegh P. Clinical picture of primary HIV infection presenting as a glandular-fever-like illness. BMJ 1988; 297:1363.
16) Schacker T, Collier AC, Hughes J, et al. Clinical and epidemiologic features of primary HIV infection. Ann Intern Med 1996; 125:257.
17) Tindall B, Cooper DA. Primary HIV infection: host responses and intervention strategies. AIDS 1991; 5:1.
18) Valle SL. Febrile pharyngitis as the primary sign of HIV infection in a cluster of cases linked by sexual contact. Scand J Infect Dis 1987; 19:13.
19) de Jong MD, Hulsebosch HJ, Lange JM. Clinical, virological and immunological features of primary HIV-1 infection. Genitourin Med 1991; 67:367.
20) Lapins J, Gaines H, Lindbäck S, et al. Skin and mucosal characteristics of symptomatic primary HIV-1 infection. AIDS Patient Care STDS 1997; 11:67.
21) Stamm WE, Handsfield HH, Rompalo AM, et al. The association between genital ulcer disease and acquisition of HIV infection in homosexual men. JAMA 1988; 260:1429.
22) Rabeneck L, Popovic M, Gartner S, et al. Acute HIV infection presenting with painful swallowing and esophageal ulcers. JAMA 1990; 263:2318.
23) Calabrese LH, Proffitt MR, Levin KH, et al. Acute infection with the human immunodeficiency virus (HIV) associated with acute brachial neuritis and exanthematous rash. Ann Intern Med 1987; 107:849.
24) Rizzardi GP, Tambussi G, Lazzarin A. Acute pancreatitis during primary HIV-1 infection. N Engl J Med 1997; 336:1836.
25) Molina JM, Welker Y, Ferchal F, et al. Hepatitis associated with primary HIV infection. Gastroenterology 1992; 102:739.
26) Meersseman W, Van Laethem K, Lagrou K, et al. Fatal brain necrosis in primary HIV infection. Lancet 2005; 366:866.
27) Ho DD, Sarngadharan MG, Resnick L, et al. Primary human T-lymphotropic virus type III infection. Ann Intern Med 1985; 103:880.
28) Ho DD, Rota TR, Schooley RT, et al. Isolation of HTLV-III from cerebrospinal fluid and neural tissues of patients with neurologic syndromes related to the acquired immunodeficiency syndrome. N Engl J Med 1985; 313:1493.
29) Carne CA, Tedder RS, Smith A, et al. Acute encephalopathy coincident with seroconversion for anti-HTLV-III. Lancet 1985; 2:1206.
30) Denning DW, Anderson J, Rudge P, Smith H. Acute myelopathy associated with primary infection with human immunodeficiency virus. Br Med J (Clin Res Ed) 1987; 294:143.
31) Hagberg L, Malmvall BE, Svennerholm L, et al. Guillain-Barré syndrome as an early manifestation of HIV central nervous system infection. Scand J Infect Dis 1986; 18:591.
32) Parry GJ. Peripheral neuropathies associated with human immunodeficiency virus infection. Ann Neurol 1988; 23 Suppl:S49
33) Piette AM, Tusseau F, Vignon D, et al. Acute neuropathy coincident with seroconversion for anti-LAV/HTLV-III. Lancet 1986; 1:852.
34) Ong EL, Mandal BK. Primary HIV-I infection associated with pneumonitis. Postgrad Med J 1991; 67:579.
35) Longworth DL, Spech TJ, Ahmad M, et al. Lymphocytic alveolitis in primary HIV infection. Cleve Clin J Med 1990; 57:379.
36) Mahé A, Bruet A, Chabin E, Fendler JP. Acute rhabdomyolysis coincident with primary HIV-1 infection. Lancet 1989; 2:1454.
37) Bernard E, Dellamonica P, Michiels JF, et al. Heparine-like anticoagulant vasculitis associated with severe primary infection by HIV. AIDS 1990; 4:932.
38) Gupta KK. Acute immunosuppression with HIV seroconversion. N Engl J Med 1993; 328:288.
39) Cilla G, Perez Trallero E, Furundarena JR, et al. Esophageal candidiasis and immunodeficiency associated with acute HIV infection. AIDS 1988; 2:399.
40) Isaksson B, Albert J, Chiodi F, et al. AIDS two months after primary human immunodeficiency virus infection. J Infect Dis 1988; 158:866.
41) Tindall B, Hing M, Edwards P, et al. Severe clinical manifestations of primary HIV infection. AIDS 1989; 3:747.
42) Vento S, Di Perri G, Garofano T, et al. Pneumocystis carinii pneumonia during primary HIV-1 infection. Lancet 1993; 342:24.
43) Moss PJ, Read RC, Kudesia G, McKendrick MW. Prolonged cryptosporidiosis during primary HIV infection. J Infect 1995; 30:51.
44) Cooper DA, Tindall B, Wilson EJ, et al. Characterization of T lymphocyte responses during primary infection with human immunodeficiency virus. J Infect Dis 1988; 157:889.
45) Vidrih JA, Walensky RP, Sax PE, Freedberg KA. Positive Epstein-Barr virus heterophile antibody tests in patients with primary human immunodeficiency virus infection. Am J Med 2001; 111:192.
46) Colven R, Harrington RD, Spach DH, et al. Retroviral rebound syndrome after cessation of suppressive antiretroviral therapy in three patients with chronic HIV infection. Ann Intern Med 2000; 133:430.
47) Kilby JM, Goepfert PA, Miller AP, et al. Recurrence of the acute HIV syndrome after interruption of antiretroviral therapy in a patient with chronic HIV infection: A case report. Ann Intern Med 2000; 133:435.
48) Daar ES, Bai J, Hausner MA, et al. Acute HIV syndrome after discontinuation of antiretroviral therapy in a patient treated before seroconversion. Ann Intern Med 1998; 128:827.
49) http://www.cdc.gov/hiv/pdf/HIVtestingAlgorithmRecommendation-Final.pdf (Accessed on June 30, 2014).
50) Centers for Disease Control and Prevention (CDC). Detection of acute HIV infection in two evaluations of a new HIV diagnostic testing algorithm - United States, 2011-2013. MMWR Morb Mortal Wkly Rep 2013; 62:489.
51) Rich JD, Merriman NA, Mylonakis E, et al. Misdiagnosis of HIV infection by HIV-1 plasma viral load testing: a case series. Ann Intern Med 1999; 130:37.
52) Schwartz DH, Laeyendecker OB, Arango-Jaramillo S, et al. Extensive evaluation of a seronegative participant in an HIV-1 vaccine trial as a result of false-positive PCR. Lancet 1997; 350:256.
53) Stekler J, Maenza J, Stevens CE, et al. Screening for acute HIV infection: lessons learned. Clin Infect Dis 2007; 44:459.
54) Hecht FM, Busch MP, Rawal B, et al. Use of laboratory tests and clinical symptoms for identification of primary HIV infection. AIDS 2002; 16:1119.
55) Pilcher CD, Fiscus SA, Nguyen TQ, et al. Detection of acute infections during HIV testing in North Carolina. N Engl J Med 2005; 352:1873.
56) Patel P, Mackellar D, Simmons P, et al. Detecting acute human immunodeficiency virus infection using 3 different screening immunoassays and nucleic acid amplification testing for human immunodeficiency virus RNA, 2006-2008. Arch Intern Med 2010; 170:66.
57) Cohen MS, Gay CL, Busch MP, Hecht FM. The detection of acute HIV infection. J Infect Dis 2010; 202 Suppl 2:S270.
58) Fiebig EW, Wright DJ, Rawal BD, et al. Dynamics of HIV viremia and antibody seroconversion in plasma donors: implications for diagnosis and staging of primary HIV infection. AIDS 2003; 17:1871.
59) Pandori MW, Hackett J Jr, Louie B, et al. Assessment of the ability of a fourth-generation immunoassay for human immunodeficiency virus (HIV) antibody and p24 antigen to detect both acute and recent HIV infections in a high-risk setting. J Clin Microbiol 2009; 47:2639.
60) Chavez P, Wesolowski L, Patel P, et al. Evaluation of the performance of the Abbott ARCHITECT HIV Ag/Ab Combo Assay. J Clin Virol 2011; 52 Suppl 1:S51.
61) Owen SM. Testing for acute HIV infection: implications for treatment as prevention. Curr Opin HIV AIDS 2012; 7:125.
62) Branson BM, Stekler JD. Detection of acute HIV infection: we can't close the window. J Infect Dis 2012; 205:521.
63) Delaney KP, Hanson DL, Masciotra S, et al. Time Until Emergence of HIV Test Reactivity Following Infection With HIV-1: Implications for Interpreting Test Results and Retesting After Exposure. Clin Infect Dis 2017; 64:53.
64) De Souza MS, Phanuphak N, Pinyakorn S, et al. Impact of nucleic acid testing relative to antigen/antibody combination immunoassay on the detection of acute HIV infection. AIDS 2015; 29:793.
65) Peters PJ, Westheimer E, Cohen S, et al. Screening Yield of HIV Antigen/Antibody Combination and Pooled HIV RNA Testing for Acute HIV Infection in a High-Prevalence Population. JAMA 2016; 315:682.
66) Rosenberg NE, Kamanga G, Phiri S, et al. Detection of acute HIV infection: a field evaluation of the determine® HIV-1/2 Ag/Ab combo test. J Infect Dis 2012; 205:528.
67) Kassutto S, Johnston MN, Rosenberg ES. Incomplete HIV type 1 antibody evolution and seroreversion in acutely infected individuals treated with early antiretroviral therapy. Clin Infect Dis 2005; 40:868.
68) Hare CB, Pappalardo BL, Busch MP, et al. Seroreversion in subjects receiving antiretroviral therapy during acute/early HIV infection. Clin Infect Dis 2006; 42:700.
69) Selleri M, Orchi N, Zaniratti MS, et al. Effective highly active antiretroviral therapy in patients with primary HIV-1 infection prevents the evolution of the avidity of HIV-1-specific antibodies. J Acquir Immune Defic Syndr 2007; 46:145.
70) Connick E. Incomplete antibody evolution and seroreversion after treatment of primary HIV type 1 infection: what is the clinical significance? Clin Infect Dis 2005; 40:874.
71) Hirsch MS, Günthard HF, Schapiro JM, et al. Antiretroviral drug resistance testing in adult HIV-1 infection: 2008 recommendations of an International AIDS Society-USA panel. Clin Infect Dis 2008; 47:266.
72) Yanik EL, Napravnik S, Hurt CB, et al. Prevalence of transmitted antiretroviral drug resistance differs between acutely and chronically HIV-infected patients. J Acquir Immune Defic Syndr 2012; 61:258.
73) Jain V, Liegler T, Vittinghoff E, et al. Transmitted drug resistance in persons with acute/early HIV-1 in San Francisco, 2002-2009. PLoS One 2010; 5:e15510.
74) Hurt CB, McCoy SI, Kuruc J, et al. Transmitted antiretroviral drug resistance among acute and recent HIV infections in North Carolina from 1998 to 2007. Antivir Ther 2009; 14:673.
75) Smith DM, Wong JK, Shao H, et al. Long-term persistence of transmitted HIV drug resistance in male genital tract secretions: implications for secondary transmission. J Infect Dis 2007; 196:356.
76) Daar ES, Moudgil T, Meyer RD, Ho DD. Transient high levels of viremia in patients with primary human immunodeficiency virus type 1 infection. N Engl J Med 1991; 324:961.
77) Celum CL, Robinson NJ, Cohen MS. Potential effect of HIV type 1 antiretroviral and herpes simplex virus type 2 antiviral therapy on transmission and acquisition of HIV type 1 infection. J Infect Dis 2005; 191 Suppl 1:S107.
78) Colfax GN, Buchbinder SP, Cornelisse PG, et al. Sexual risk behaviors and implications for secondary HIV transmission during and after HIV seroconversion. AIDS 2002; 16:1529.
79) Hollingsworth TD, Pilcher CD, Hecht FM, et al. High Transmissibility During Early HIV Infection Among Men Who Have Sex With Men-San Francisco, California. J Infect Dis 2015; 211:1757.
80) Wawer MJ, Gray RH, Sewankambo NK, et al. Rates of HIV-1 transmission per coital act, by stage of HIV-1 infection, in Rakai, Uganda. J Infect Dis 2005; 191:1403.
81) Brenner BG, Roger M, Routy JP, et al. High rates of forward transmission events after acute/early HIV-1 infection. J Infect Dis 2007; 195:951.
82) O'Brien M, Markowitz M. Should we treat acute HIV infection? Curr HIV/AIDS Rep 2012; 9:101.
83) Patterson KB, Leone PA, Fiscus SA, et al. Frequent detection of acute HIV infection in pregnant women. AIDS 2007; 21:2303.
84) Daar ES, Pilcher CD, Hecht FM. Clinical presentation and diagnosis of primary HIV-1 infection. Curr Opin HIV AIDS 2008; 3:10.
85) Kelley CF, Barbour JD, Hecht FM. The relation between symptoms, viral load, and viral load set point in primary HIV infection. J Acquir Immune Defic Syndr 2007; 45:445.
86) Lavreys L, Baeten JM, Chohan V, et al. Higher set point plasma viral load and more-severe acute HIV type 1 (HIV-1) illness predict mortality among high-risk HIV-1-infected African women. Clin Infect Dis 2006; 42:1333.